Centers for Disease Control and Prevention, U.S.A.
https://www.cdc.gov/mmwr/volumes/70/wr/mm7013e3.htm
Resumen
¿Qué se sabe ya sobre este tema?
Se ha demostrado que las vacunas contra COVID-19 de ARN mensajero (ARNm) son eficaces para prevenir la infección sintomática del SARS-CoV-2 en ensayos de fase III aleatorizados y controlados con placebo.
¿Qué agrega este informe?
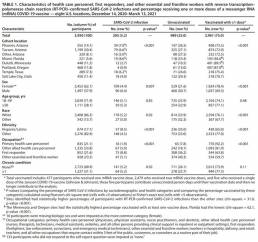
Cohortes prospectivas de 3.950 miembros del personal de atención médica, personal de primeros auxilios y otros trabajadores esenciales y de primera línea completaron las pruebas semanales de SARS-CoV-2 durante 13 semanas consecutivas. En condiciones del mundo real, la eficacia de la vacuna de ARNm de la inmunización completa (≥14 días después de la segunda dosis) fue del 90% contra las infecciones por SARS-CoV-2 independientemente del estado de los síntomas; la eficacia de la vacuna de la inmunización parcial (≥14 días después de la primera dosis pero antes de la segunda dosis) fue del 80%.
¿Cuáles son las implicaciones para la práctica de la salud pública?
Las vacunas de ARNm COVID-19 autorizadas son efectivas para prevenir la infección por SARS-CoV-2 en condiciones del mundo real. Se recomienda la vacuna COVID-19 para todas las personas elegibles.
Comunicación completa
Se ha demostrado que las vacunas de ARN mensajero (ARNm) BNT162b2 (Pfizer-BioNTech) y ARNm-1273 (Moderna) COVID-19 son eficaces para prevenir el COVID-19 sintomático en ensayos aleatorizados de fase III controlados con placebo; sin embargo, los beneficios de estas vacunas para prevenir la infección asintomática y sintomática del SARS-CoV-2 (el virus que causa COVID-19), particularmente cuando se administran en condiciones del mundo real, son menos conocidos. Utilizando cohortes prospectivas de personal de atención médica, socorristas y otros trabajadores esenciales y de primera línea en ocho ubicaciones de EE. UU. durante el período del 14 de diciembre de 2020 al 13 de marzo de 2021, los CDC realizaron pruebas de rutina para detectar infecciones por SARS-CoV-2 cada semana, independientemente del estado de los síntomas y al inicio de los síntomas compatibles con la enfermedad asociada a COVID-19. Entre 3.950 participantes sin documentación previa de laboratorio de infección por SARS-CoV-2, 2.479 (62,8%) recibieron las dos dosis recomendadas de ARNm y 477 (12,1%) recibieron solo una dosis de la vacuna de ARNm. Entre los participantes no vacunados, se confirmaron 2 infecciones mediante la reacción en cadena de la polimerasa con transcripción inversa (RT-PCR) por 1000 días-persona. En contraste, entre las personas completamente inmunizadas (≥14 días después de la segunda dosis), se notificaron 0,04 infecciones por 1000 días-persona, y entre las personas parcialmente inmunizadas (≥14 días después de la primera dosis y antes de la segunda dosis), se notificaron 0,19 infecciones por 1.000 días-persona. La efectividad estimada de la vacuna de ARNm para la prevención de infecciones, ajustada para el sitio del estudio, fue del 90% para la inmunización completa y del 80% para la inmunización parcial. Estos hallazgos indican que las vacunas COVID-19 de ARNm autorizadas son efectivas para prevenir la infección por SARS-CoV-2, independientemente del estado de los síntomas, entre adultos en edad laboral en condiciones del mundo real. Se recomienda la vacuna COVID-19 para todas las personas elegibles.
HEROES-RECOVER es una red de cohortes longitudinales en ocho ubicaciones (Phoenix, Tucson y otras áreas en Arizona; Miami, Florida; Duluth, Minnesota; Portland, Oregon; Temple, Texas; y Salt Lake City, Utah) que comparten un protocolo y métodos comunes. La inscripción en este estudio longitudinal comenzó en julio de 2020 e incluyó personal de atención médica, personal de primera respuesta y otros trabajadores esenciales y de primera línea que proporcionaron su consentimiento por escrito. El período actual del estudio analítico de efectividad de la vacuna comenzó el primer día de administración de la vacuna en los sitios de estudio (14 al 18 de diciembre de 2020) y finalizó el 13 de marzo de 2021.
La vigilancia activa de los síntomas consistentes con la enfermedad asociada a COVID-19 (definida como fiebre, escalofríos, tos, dificultad para respirar, dolor de garganta, diarrea, dolores musculares o pérdida del olfato o el gusto) se efectuaron a través de mensajes de texto semanales, correos electrónicos e informes directos de participantes o registros médicos. Los participantes recolectaron por sí mismos un hisopo nasal de cornete medio semanalmente, independientemente del estado de los síntomas de la enfermedad asociados con COVID-19 y recolectaron un hisopo nasal adicional y una muestra de saliva al inicio de la enfermedad asociada al COVID-19. Las muestras enviadas en paquetes fríos se analizaron mediante un ensayo de RT-PCR en el Laboratorio de la Clínica Marshfield (Marshfield, Wisconsin) para determinar las infecciones por SARS-CoV-2 (infección confirmada por PCR). La recepción de las vacunas COVID-19 se documentó mediante varios métodos: mediante el autoinforme en encuestas electrónicas, mediante entrevistas telefónicas y mediante la carga directa de imágenes de tarjetas de vacuna en todos los sitios. Los registros también se extrajeron de registros médicos electrónicos en los sitios de Minnesota, Oregon, Texas y Utah. Entre 5.077 participantes, se excluyeron aquellos con documentación de laboratorio de infección por SARS-CoV-2 antes de la inscripción a partir de julio de 2020 (608) o identificados como parte de la vigilancia longitudinal hasta el primer día de administración de la vacuna (240). Otros 279 fueron excluidos debido a la baja participación (es decir, no completaron la vigilancia durante ≥20% de las semanas del estudio y no contribuyeron con muestras de enfermedades asociadas a COVID-19). En total, se analizaron 3.950 participantes en la muestra analítica de efectividad de la vacuna.
Las razones de riesgo se estimaron mediante la extensión de Andersen-Gill del modelo de riesgos prorcionales de Cox, que tuvo en cuenta el estado de vacunación variable en el tiempo. Se calcularon por separado las razones de riesgo de días-persona no vacunados respecto a días-persona de inmunización parcial (≥14 días después de la primera dosis y antes de la segunda dosis) y días-persona de inmunización completa (≥14 días después de la segunda dosis). Los 13 días-persona entre la administración de la vacuna y la inmunización parcial o total se consideraron excluidos del tiempo-persona de riesgo porque la inmunidad se consideró indeterminada. La efectividad de la vacuna no ajustada se calculó como 100% × (razón de riesgo 1). Un modelo ajustado de efectividad de la vacuna incluyó el sitio de estudio como una covariable. Todos los análisis se realizaron con SAS (versión 9.4; SAS Institute). Esta actividad fue revisada por los CDC y se llevó a cabo de acuerdo con la ley federal aplicable y la política de los CDC.
Aproximadamente la mitad de los participantes (52,6%) eran de los sitios de estudio de Arizona. Los participantes incluyeron médicos y otros clínicos (personal de atención primaria de salud) (21,1%), enfermeras y otro personal de atención de la salud afín (33,8%), personal de primera respuesta (21,6%) y otros trabajadores esenciales y de primera línea (23,5%). La mayoría de los participantes eran mujeres (62,1%), de 18 a 49 años (71,9%), blancos (86,3%) y no hispanos (82,9%) y no tenían enfermedades crónicas (68,9%). Durante el período de estudio de 13 semanas, el cumplimiento de los informes de vigilancia semanales y la recolección de muestras fue alto (mediana = 100%; rango intercuartílico = 82% -100%).
La mayoría (75,0%) de los participantes recibió una o más dosis de vacuna durante el período de estudio. 477 (12,1%) recibieron su primera dosis y no habían recibido su segunda dosis al final del período de estudio, y 2.479 (62,8%) recibieron ambas dosis de vacuna de ARNm recomendadas. La mayoría (60,5%) se vacunó con su primera dosis durante el 14 al 31 de diciembre de 2020. Ambos productos de la vacuna de ARNm se administraron a los participantes en todos los lugares, pero difirieron en el momento de su disponibilidad; El 62,7% de los participantes vacunados recibió la vacuna Pfizer-BioNTech y el 29,6% recibió la vacuna Moderna. Las vacunas de ARNm restantes (7,7%) están pendientes de verificación del producto. La recepción de al menos una dosis de vacuna fue significativamente mayor entre los participantes que eran mujeres, blancos, no hispanos, personal de atención médica o que vivían en Minnesota u Oregon; la cobertura de vacunas fue más baja en Florida.
La infección por SARS-CoV-2 se diagnosticó mediante RT-PCR en 205 (5,2%) participantes. La infección confirmada por PCR fue significativamente mayor entre los participantes que eran hombres, hispanos, primeros respondedores o que vivían en Arizona, Florida y Texas. La mayoría de las infecciones confirmadas por PCR se identificaron mediante muestras semanales (58%), mientras que el 42% se identificaron a partir de muestras recolectadas al inicio de la enfermedad asociada a COVID-19. No obstante, la mayoría (87,3%) de las infecciones confirmadas por PCR se asociaron con síntomas compatibles con la enfermedad asociada a COVID-19. Las infecciones restantes confirmadas por PCR se asociaron con otros síntomas que no forman parte de la definición de enfermedad asociada a COVID-19 (p. ej., dolor de cabeza, fatiga y rinorrea) (2,0%) o ningún síntoma (10,7%). Sólo el 22,9% de las infecciones confirmadas por PCR fueron atendidas médicamente, incluidas dos hospitalizaciones; no se produjeron muertes.
Durante los 116.657 días-persona en los que los participantes no estaban vacunados, se identificaron 161 infecciones confirmadas por PCR (tasa de incidencia = 1,38 / 1000 días-persona). Durante los 13 días posteriores a la primera o segunda dosis de vacunación, cuando el estado inmunológico se consideró indeterminado (67 483 días-persona), se identificaron 33 infecciones confirmadas por PCR y se excluyeron del resultado. Se notificaron cinco infecciones confirmadas por PCR durante 15.868 días-persona ≥ 14 días después de su primera dosis entre aquellos que no recibieron su segunda dosis durante el período de estudio; Se notificaron tres infecciones confirmadas por PCR durante 25.988 días-persona ≥14 días después de la primera dosis y hasta la recepción de la segunda dosis. En conjunto, esto representa ocho infecciones confirmadas por PCR que ocurrieron durante 41.856 días-persona con inmunización parcial (≥14 días después de la primera dosis y antes de la segunda dosis; tasa de incidencia = 0.19 / 1,000 días-persona). Se produjeron tres infecciones confirmadas por PCR durante 78.902 días-persona con inmunización completa (≥14 días después de la segunda dosis; tasa de incidencia = 0,04 / 1000 días-persona). La efectividad ajustada estimada de la vacuna de la inmunización completa fue del 90% (intervalo de confianza [IC] del 95% = 68% -97%); la efectividad de la vacuna de la inmunización parcial fue del 80% (IC del 95% = 59% -90%) (Tabla 2). En los análisis de sensibilidad, la inclusión de otras covariables (sexo, edad, etnia y ocupación) se ingresaron individualmente en el modelo de efectividad de la vacuna; el cambio en las estimaciones puntuales de la eficacia de la vacuna fue <3%.
Discusión
Cohortes prospectivas de personal de atención médica, socorristas y otros trabajadores esenciales y de primera línea durante 13 semanas en ocho ubicaciones de EE. UU. confirmaron que las vacunas de ARNm COVID-19 autorizadas (BNT162b2 de Pfizer-BioNTech y ARNm-1273 de Moderna) son altamente efectivas en condiciones del mundo real. La eficacia de la vacuna de la inmunización completa con dos dosis de vacunas de ARNm fue del 90% (IC del 95% = 68% -97%) contra la infección por SARS-CoV-2 confirmada por RT-PCR. Estos hallazgos concuerdan con los de los ensayos de fase III de las vacunas de ARNm y los estudios observacionales recientes de la eficacia de la vacuna de ARNm contra el COVID-19 grave (3). Los hallazgos complementan y amplían estos informes anteriores al demostrar que las vacunas también pueden reducir el riesgo de infección independientemente del estado de los síntomas de la enfermedad asociada a COVID-19. La reducción del riesgo de infección transmisible, que puede ocurrir entre personas con infección asintomática o entre personas varios días antes de la aparición de los síntomas, es especialmente importante entre el personal de atención de la salud, los socorristas y otros trabajadores esenciales y de primera línea, dado su potencial para transmitir la enfermedad a través del contacto cercano frecuente con los pacientes y el público.
La inmunización parcial (≥14 días después de la primera dosis pero antes de la segunda) proporcionó beneficios preventivos con una efectividad de la vacuna del 80%. Este hallazgo es similar a un análisis de los resultados del ensayo de fase III y otras dos estimaciones recientes de la efectividad de la vacuna para la inmunización parcial con la vacuna Pfizer-BioNTech entre el personal de atención médica, incluida una efectividad de la vacuna (≥21 días después de la primera dosis) del 72% (IC del 95% = 58% -86%) contra la infección confirmada por PCR identificada mediante pruebas de rutina en el Reino Unido (4) y una efectividad de la vacuna (> 14 días después de la primera dosis) del 60% (95% IC = 38% -74%) contra la infección confirmada por PCR identificada por la revisión de registros en Israel. Este hallazgo también es consistente con los primeros hallazgos descriptivos de los resultados de las pruebas clínicas según el estado de vacunación del ARNm en los Estados Unidos.
Los hallazgos de este informe están sujetos al menos a tres limitaciones.
En primer lugar, las estimaciones puntuales de la eficacia de la vacuna deben interpretarse con precaución dados los IC moderadamente amplios atribuibles en parte al número limitado de infecciones confirmadas por PCR post-inmunización observadas.
En segundo lugar, esto también impidió realizar estimaciones de la eficacia de la vacuna para un producto específico y limitó la capacidad de ajustar los posibles factores de confusión; sin embargo, los efectos no cambiaron en gran medida cuando el sitio del estudio se incluyó en un modelo ajustado de efectividad de la vacuna y cuando se ajustó por sexo, edad, etnia y ocupación por separado en los análisis de sensibilidad.
Por último, la auto-colección de muestras y las demoras en los envíos podrían reducir la sensibilidad de la detección del virus por PCR; si esto afectara de manera desproporcionada a quienes recibieron la vacuna (por ejemplo, debido a la posible atenuación de la vacuna contra la diseminación del virus), se sobrestimaría la efectividad de la vacuna.
El rigor científico de estos hallazgos se ve reforzado por su diseño prospectivo y la muy alta adherencia de los participantes a la recolección semanal de muestras. Dado que existe incertidumbre en relación con el número de días necesarios para desarrollar la inmunidad después de la vacunación, se justifica la realización de investigaciones futuras que examinen la eficacia de la vacuna en diferentes intervalos.
Estos hallazgos provisionales de efectividad de la vacuna para las vacunas de ARNm de Pfizer-BioNTech y Moderna en condiciones del mundo real complementan y amplían las estimaciones de efectividad de la vacuna de otros estudios recientes y demuestran que los esfuerzos de vacunación actuales están resultando en beneficios preventivos sustanciales entre los trabajadores adultos. Refuerzan la recomendación de los CDC de una inmunización completa de 2 dosis con vacunas de ARNm. Se recomienda la vacuna COVID-19 para todas las personas elegibles, que actualmente varía según la ubicación en los Estados Unidos.

Estimaciones provisionales de la eficacia de la vacuna de las vacunas BNT162b2 y mRNA-1273
Día de la obstetricia y la embarazada
¿Cómo se transforma la incertidumbre en una experiencia segura y asombrosa? Con una conexión única que hace de cada embarazo un viaje inolvidable.…
Los alimentos ricos en potasio mejoran la salud cardiovascular de las mujeres
De acuerdo con la Organización Mundial de la Salud (OMS), las enfermedades cardiovasculares (ECV) son la principal causa de muerte en todo el mundo y…
Viruela del mono: la OMS declara alerta máxima por el aumento de casos en el mundo
La Organización Mundial de la Salud ha declarado este sábado 23 de julio a la viruela de mono como una emergencia sanitaria internacional luego de un…
Los trastornos de ansiedad podrían transmitirse de padres a hijos y de madres a hijas
¿Difiere la probabilidad de transmisión de los trastornos de ansiedad de padres a hijos entre parejas de padres e hijos del mismo sexo y de sexo…




