Calidad de vida de pacientes anticoagulados con Apixabán. Resultados del Programa Aristóteles.
Megalabs presenta los resultados del ‘Programa Aristóteles’, que refiere a la Evaluación de Calidad de Vida en pacientes tratados con #Mantixa® primer Apixabán bioequivalente de Latinoamérica. Inspirados en uno de los grandes filósofos y pensadores de la historia, cuyos estudios influenciaron el desarrollo de la ciencia y la medicina, Megalabs impulsó en cinco países una encuesta en 500 pacientes. Su objetivo: evaluar aspectos de la vida cotidiana de pacientes en tratamiento con Mantixa®

SARS-CoV-2 infecta varios tipos celulares a través de los receptores ACE2 y TMPRSS2
El virus SARS-CoV-2 es el responsable de generar la pandemia que cuenta con mas de 4 millones de infectados a nivel global, y más de 280 mil muertes. Este virus pertenece a la familia de los Coronavirus, y se caracteriza principalmente por poseer ARN de cadena positiva y ser envuelto. Al ser observado en el microscopio se puede ver que la envoltura presenta unas proteínas que asemejan al aspecto de una corona. La proteína responsable de dicho aspecto se denomina proteína espiga (“spike” en inglés), y no solamente es responsable de ello sino también de mediar el ingreso del virus a la célula y por tanto de la capacidad infectiva viral.
La proteína espiga es capaz de reconocer al receptor celular de la enzima convertidora de angiotensina 2 (ACE2) y a través de él ingresar a las células que lo posean. Sin embargo, este proceso no es tan sencillo puesto que requiere a su vez de una proteasa celular que favorezca el clivaje de la proteína espiga y la fusión de las membranas celular y viral. Esta proteasa transmembrana celular se denomina TMPRSS2. (1)
Los receptores a los que se une SARS-CoV-2 están presentes en diversos órganos, tales como pulmón, corazón, vejiga, riñón, intestino, nariz y páncreas. Afecciones pulmonares y cardíacas han sido observadas, como también trastornos gastrointestinales y pérdida de olfato en algunos pacientes. Por otra parte, se ha visto presencia de carga viral en lágrimas, secreciones oculares y heces de ciertos pacientes, además de en la saliva y secreciones nasales. (1-4)
Estos hechos, tomados en su conjunto, sugieren que el virus, una vez circulante en el ser humano, puede potencialmente infectar diversos órganos generando los distintos cuadros clínicos que han sido observados en pacientes con Covid-19. Futuras investigaciones serán requeridas para afirmar que el virus es capaz de infectar a todas las células que poseen ambos receptores; pero estos datos son el puntapié inicial que podría explicar el motivo de los diversos efectos que se ven en los pacientes infectados con SARS-CoV-2. (2)
Bibliografía:
1- Hoffman et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 202. 181(2): 271–280.e8. Doi:
10.1016/j.cell.2020.02.052
2- Baraniuk. Receptors for SARS-CoV-2 Present in Wide Variety of Human Cells. The Scientist. 29 Abril 2020. Extraído de:
https://www.the-scientist.com/news-opinion/receptors-for-sars-cov-2-present-in-wide-variety-of-human-cells-67496
3- Burgueño et al. Expression of SARS-CoV-2 Entry Molecules ACE2 and TMPRSS2 in the Gut of Patients With IBD. Inflamm Bowel Dis. 2020. pii: izaa085. Doi:
10.1093/ibd/izaa085.
4- Lukassen et al. SARS-CoV-2 receptor ACE2 and TMPRSS2 are primarily expressed in bronchial transient secretory cells. EMBO J. 2020. e105114. Doi:
10.15252/embj.20105114.
Conexion Megalabs - SARS-CoV-2 infecta varios tipos celulares a través de los receptores ACE2 y TMPRSS2

Ibuprofeno
Ibuprofeno es un derivado del ácido fenil-propiónico con propiedades antiinflamatorias, antipiréticas y analgésicas; su acción analgésica no es de tipo narcótico y su actividad farmacológica se basa en la inhibición de la síntesis de prostaglandinas a nivel periférico. Las prostaglandinas desempeñan un papel esencial en la aparición de la fiebre, del dolor y de la inflamación. (1,2) Fue aprobado por la FDA en 1981. (3)
Datos experimentales sugieren que ibuprofeno puede inhibir de forma competitiva el efecto de dosis bajas de ácido acetilsalicílico sobre la agregación plaquetaria cuando se administran de forma concomitante. Algunos estudios farmacodinámicos mostraron que cuando se toman dosis únicas de ibuprofeno 400 mg en las 8 h anteriores o en los 30 minutos posteriores a la dosificación de ácido acetilsalicílico de liberación inmediata (81 mg), se redujo el efecto del ácido acetilsalicílico sobre la formación de tromboxano o la agregación plaquetaria. Aunque hay ciertas dudas respecto a la extrapolación de estos datos a la situación clínica, la posibilidad de que el uso habitual a largo plazo de ibuprofeno pueda reducir el efecto cardioprotector de dosis bajas de ácido acetilsalicílico no puede excluirse. Se considera que es probable que no haya un efecto clínicamente relevante con el uso ocasional del ibuprofeno. (1,2)
El papel de los AINEs en el manejo del SARS-CoV2 ha sido ampliamente discutido. Informes y advertencias de funcionarios de salud han sugerido contra el uso de AINEs en la atención de pacientes con COVID-19; sin embargo, ni la FDA, la EMA u OMS han identificado evidencia que relacione los AINEs con el deterioro clínico relacionado con COVID. Los coronavirus humanos, incluido el SARS CoV-2, usan ACE2 para unirse a sus targets y obtener acceso a las células objetivo. Se ha teorizado que los AINEs, debido a la regulación positiva en ACE2 en células diana humanas, pueden conducir a un curso más grave de COVID-19. Si bien no se ha publicado eventos adversos con causalidad definitiva con AINEs en el tratamiento de COVID-19, existen riesgos bien conocidos de agentes antiinflamatorios no esteroideos que incluyen eventos adversos cardiovasculares, gastrointestinales y renales. En el contexto de la neumonía bacteriana, los AINEs pueden disminuir el reclutamiento de células polimorfonucleares, lo que resulta en una respuesta inflamatoria tardía y una tardía resolución de la infección. Sin embargo, no se ha establecido una relación causal. Se necesitan estudios clínicos para comprender mejor la seguridad de los AINEs en el tratamiento de pacientes con COVID-19. Actualmente se está llevando a cabo un estudio clínico para evaluar el papel del naproxeno en los pacientes críticos con COVID-19. (4,5)
El 19 de marzo del 2020, la FDA emitió un comunicado estableciendo que hasta el momento, la FDA no tiene conocimiento de evidencia científica que relacione el uso de AINEs, como el ibuprofeno, con el empeoramiento de los síntomas de COVID-19. La agencia está investigando esto más a fondo y se comunicará públicamente cuando haya más información disponible. Sin embargo, todas las etiquetas de AINEs recetadas advierten que «la actividad farmacológica de los AINE para reducir la inflamación, y posiblemente la fiebre, puede disminuir la utilidad de los signos de diagnóstico para detectar infecciones». (6)
La guía de la Universidad de Washington menciona que no existe evidencia que respalde su uso para mitigar la respuesta inflamatoria asociada con COVID-19. Se han expresado inquietudes con respecto al empeoramiento clínico de COVID-19 en pacientes que toman Ibuprofeno, pero en este momento no tienen fundamento. No recomiendan los AINEs principalmente debido a la falta de evidencia para el beneficio. Estos medicamentos también pueden exacerbar la lesión renal aguda en el contexto de una enfermedad grave. (7)
Estudios clínicos con COVID-19
Debajo se encuentra el link a los estudios clínicos en curso, planificados y finalizados que involucran COVID-19 e Ibuprofeno:
https://clinicaltrials.gov/ct2/results?cond=COVID&term=ibuprofen&cntry=&state=&city=&dist=
Dosis y administración (1)
Adolescentes a partir de 12 años (de más de 40 kg de peso) y adultos:
200 mg- 400 mg de ibuprofeno cada 4-8 horas. No se tomarán más de 1.200 mg al cabo de 24 horas.
El intervalo entre dosis dependerá de la evolución de los síntomas, pero nunca será inferior a 4 horas.
Población pediátrica:
La dosis a administrar de ibuprofeno depende de la edad y el peso del paciente:
Niños de 20 a 29 Kg de peso (7-8 años aproximadamente):
La dosis recomendada 200 mg de ibuprofeno tres veces al día, siendo la dosis máxima diaria recomendada de 600 mg.
Niños de 30 a 39 kg de peso (8 -12 años aproximadamente):
La dosis recomendada es 200 mg de ibuprofeno por toma. Dependiendo del peso del niño, pueden administrarse 3 ó 4 tomas, siendo la dosis máxima diaria recomendada de 600 mg a 800 mg. El intervalo entre dosis dependerá de la evolución de los síntomas, pero nunca será inferior a 4 horas.
Niños y adolescentes de más de 40 kg de peso (mayores de 12 años):
Seguirán la posología de adultos
No se recomienda el uso de este medicamento en niños de peso inferior a 20 kg (aproximadamente 7-8 años) ya que la dosis de 200 mg de ibuprofeno no se adapta a la posología recomendada en estos pacientes.
Población de edad avanzada
La posología debe ser establecida por el médico, ya que cabe la posibilidad de que se necesite una reducción de la dosis.
Pacientes con insuficiencia renal, hepática o cardiaca:
Reducir la dosis. No se deberá utilizar ibuprofeno en pacientes con insuficiencia renal o hepática grave.
Para uso ocasional, durante periodos de tiempo limitados.
Si se requiere utilizar este medicamento durante más de 3 días en caso de fiebre o 5 días en caso de dolor en los adultos, o durante más de 3 días en niños y adolescentes, o si los síntomas empeoran, debe consultarse al médico.
Precauciones y advertencias (1)
• Sangrado gastrointestinal, úlceras y perforaciones: debe evitarse la toma de ibuprofeno en combinación con otros AINEs, incluidos inhibidores selectivos de ciclooxigenasa-2. Se han notificado casos de sangrado gastrointestinal, úlceras y perforaciones, algunos con desenlace mortal, con todos los AINEs. Se aconseja precaución en pacientes que están recibiendo medicación concomitante que podría incrementar el riesgo de úlceras o hemorragias como los corticoesteroides orales, anticoagulantes como warfarina, inhibidores selectivos de la recaptación de serotonina o inhibidores de la agregación plaquetaria como ASA. Si los pacientes que están tomando este medicamento sufren sangrado gastrointestinal o úlceras, el tratamiento debe ser interrumpido. Los AINEs deben utilizarse solo con precaución en pacientes con historial de enfermedades gastrointestinales (colitis, enfermedad de Crohn) ya que dicha enfermedad puede empeorar.
• Efectos en los sistemas cardiovascular y cerebrovascular: debe actuarse con precaución antes de comenzar el tratamiento en pacientes con historial previo de presión sanguínea elevada y/o insuficiencia cardíaca ya que se han notificado casos de retención de fluidos, hipertensión y edema asociados con la terapia con AINEs. Estudios clínicos sugieren que el uso de ibuprofeno, especialmente en dosis altas (2400 mg/día) y en tratamientos prolongados puede estar asociado a un pequeño aumento del riesgo de acontecimientos trombóticos arteriales.Los pacientes con hipertensión no controlada, insuficiencia cardiaca congestiva (II-III de NYHA), cardiopatía isquémica establecida, arteriopatía periférica y/o enfermedad cerebrovascular solo se deben tratar con ibuprofeno después de una cuidadosa valoración y se deben evitar las dosis altas (2400 mg/día). También se debe aplicar una cuidadosa valoración antes de iniciar el tratamiento a largo plazo de pacientes con factores de riesgo de acontecimientos cardiovasculares (p. ej. hipertensión, hiperlipidemia, diabetes mellitus, tabaquismo), en especial si se necesitan dosis elevadas de ibuprofeno (2400 mg/día).
• Reacciones cutáneas graves: en raras ocasiones se han notificado reacciones cutáneas graves, algunas con desenlace fatal, tales como dermatitis exfoliativa, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica (síndrome de Lyell) en asociación con el uso de AINE. Se ha notificado pustulosis exantemática generalizada aguda (PEGA) asociada a productos que contienen ibuprofeno. La administración de ibuprofeno se debe suspender ante los primeros signos o síntomas de reacciones cutáneas graves, como erupción cutánea, lesiones mucosas o cualquier otro signo de hipersensibilidad. Los pacientes que experimenten alteraciones visuales durante la terapia con ibuprofeno deberán interrumpir el tratamiento y someterse a un examen oftalmológico.
• El uso de AINEs puede enmascarar los síntomas de las infecciones. En casos excepcionales, pueden producirse infecciones cutáneas graves y complicaciones en tejido blando, durante infecciones de varicela.
• Este medicamento debe tomarse únicamente después de un estudio cuidadoso de la relación beneficio-riesgo en caso de:
- Alteraciones congénitas del metabolismo de porfirinas (ej. porfiria aguda intermitente)
- Lupus eritematoso sistémico (SLE) y colagenosis mixta (enfermedad del tejido conjuntivo mixto).
• El ibuprofeno, principio activo de este medicamento, puede inhibir temporalmente la agregación plaquetaria y prolongar el tiempo de hemorragia. Se recomienda precaución cuando se administre ibuprofeno concomitantemente con anticoagulantes orales.
• En pacientes con antecedentes isquémicos que estén en tratamiento antiagregante plaquetario con ácido acetilsalicílico de liberación rápida, se debe espaciar la toma de los 2 medicamentos, con el fin de evitar la atenuación del efecto antiagregante del ácido acetilsalicílico
• Con tratamientos de larga duración con este medicamento, resulta necesaria la monitorización regular de los valores hepáticos, función renal y recuento sanguíneo.
• Si se toman analgésicos durante largos períodos de tiempo, pueden producirse dolores de cabeza, que no deben ser tratados con dosis aún mayores del producto.
• Los pacientes que experimenten alteraciones visuales durante la terapia con ibuprofeno deberán interrumpir el tratamiento y someterse a un examen oftalmológico.
• El uso de AINEs combinado con alcohol puede incrementar los efectos adversos causados por el principio activo, en particular aquellos que afectan el tracto gastrointestinal o el sistema nervioso central.
• Fármacos que inhiben la síntesis de prostaglandinas pueden alterar la fertilidad a través de un efecto sobre la ovulación.
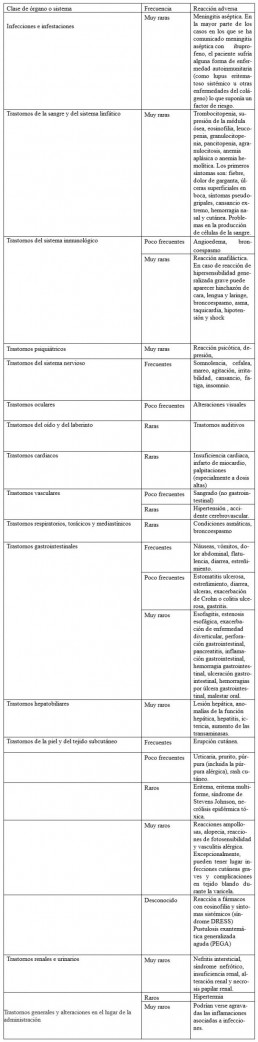
Eventos adversos (1)
Las reacciones adversas que se observan con mayor frecuencia son de naturaleza gastrointestinal. Pueden producirse úlceras pépticas, perforación o hemorragia gastrointestinal, en algunos casos mortales, especialmente en los pacientes de edad avanzada. También se han notificado náuseas, vómitos, diarrea, flatulencia, constipación, dispepsia, dolor abdominal, melena, hematemesis, estomatitis ulcerosa, exacerbación de colitis y enfermedad de Crohn. Se ha observado menos frecuentemente la aparición de gastritis.
Se han descrito casos de edema, hipertensión e insuficiencia cardiaca asociados al tratamiento con AINEs.
Inserto Ibuprofeno
(Archivo descargable)
(1) Inserto Doctril Forte 400 mg. Agencia Española de Medicamentos y Productos Sanitarios (AEMPs). 2019. Disponible en:
https://cima.aemps.es/cima/dochtml/ft/62258/FT_62258.html
(2) Inserto Ibuprofeno TecniGen 600 mg. Agencia Española de Medicamentos y Productos Sa-nitarios (AEMPs). 2018. Disponible en:
https://cima.aemps.es/cima/dochtml/ft/65912/FT_65912.html
(3) Food and Drug Administration (FDA). FDA Approved Drugs. Disponible en:
https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=018197
(4) Infectious Diseases Society of America (IDSA). Infectious Diseases Society of America Guidelines on the Treatment and Management of Patients with COVID-19. Disponible en:
https://www.idsociety.org/practice-guideline/covid-19-guideline-treatment-and-management/#toc-8
(5) Adnet F, Slama Schwok A. Efficacy of Addition of Naproxen in the Treatment of Critically Ill Patients Hospitalized for COVID-19 Infection (ENACOVID). Disponible en:
https://clinicaltrials.gov/ct2/show/NCT04325633.
(6) Food and Drug Administration (FDA). Drug Safety and Availability. Disponible en:
https://www.fda.gov/drugs/drug-safety-and-availability/fda-advises-patients-use-non-steroidal-anti-inflammatory-drugs-nsaids-covid-19
(7) Universidad de Washington. COVID-19 Treatments. Disponible en:
https://covid.idea.medicine.uw.edu/page/treatment/drugs



Conexion Ibuprofeno Update
Paracetamol
El Paracetamol fue aprobado en Estados Unidos en el año 1951 para el tratamiento del dolor leve a moderado, tratamiento del dolor severo en conjunto con un opioide y reducción de la fiebre. (1)
Tiene propiedades analgésicas y antipiréticas y es uno de los analgésicos y antipiréticos más usados a nivel mundial por su efectividad y perfil de seguridad.
El mecanismo de acción analgésica no está totalmente determinado. Puede actuar predominantemente inhibiendo la síntesis de prostaglandinas a nivel del sistema nervioso central y en menor grado bloqueando la generación del impulso doloroso a nivel periférico. La acción periférica puede deberse también a la inhibición de la síntesis de prostaglandinas o a la inhibición de la síntesis o de la acción de otras sustancias que sensibilizan los nociceptores ante estímulos mecánicos o químicos. Probablemente, el paracetamol produce el efecto antipirético actuando a nivel central sobre el centro hipotalámico regulador de la temperatura, para producir una vasodilatación periférica que da lugar a un aumento de sudoración y de flujo de sangre en la piel y pérdida de calor. La acción a nivel central probablemente está relacionada con la inhibición de la síntesis de prostaglandinas en el hipotálamo. (1)
De acuerdo a la guía de tratamiento del Massachusetts General Hospital, el acetaminofen está suge-rido como primera línea de tratamiento antipirético. (2)
Estudios clínicos con COVID-19
Debajo se encuentra el link a los estudios clínicos en curso, planificados y finalizados que involucran COVID-19 y paracetamol:
https://clinicaltrials.gov/ct2/results?cond=COVID&term=paracetamol&cntry=&state=&city=&dist=
Dosis y administración (1)
Se puede administrar en dosis simple o repetida. Para el inyectable, no se debe superar los 15 minutos de infusión.
Precauciones y advertencias (1)
• Se debe administrar el paracetamol con precaución, evitando tratamientos prolongados en pacientes con anemia, afecciones cardíacas o pulmonares o con disfunción renal (en este úl-timo caso, el uso ocasional es aceptable, pero la administración prolongada de dosis elevadas puede aumentar el riesgo de aparición de efectos renales adversos).
• En caso de insuficiencia renal grave, (aclaración de la creatinina inferior a 10 ml/min), el in-tervalo entre 2 tomas será como mínimo de 8 horas.
• La utilización de paracetamol en pacientes que consumen habitualmente alcohol (tres o más bebidas alcohólicas al día) puede provocar daño hepático.
• En alcohólicos crónicos no se debe administrar más de 2 g/día de paracetamol.
• Se recomienda precaución en pacientes asmáticos sensibles al ácido acetilsalicílico, debido a que se han descrito ligeras reacciones broncoespásmicas con paracetamol (reacción cruzada) en estos pacientes, aunque solo se manifestaron en menos del 5% de los ensayados.
• Si el dolor se mantiene durante más de 10 días o la fiebre durante más de 3 días, o empeoran o aparecen otros síntomas, se debe reevaluar la situación clínica.
• Si es clínicamente necesario, puede utilizarse paracetamol durante el embarazo, pero debe usarse la dosis mínima eficaz durante el menor tiempo posible y con la menor frecuencia po-sible.
Eventos adversos (1)
• Trastornos generales y alteraciones en el lugar de administración:
Raras: Malestar
Muy raras: Reacciones de hipersensibilidad que oscilan, entre una simple erupción cutánea o una urticaria y shock anafiláctico.
• Trastornos gastrointestinales:
Raras: Niveles aumentados de transaminasas hepáticas. Muy raras: Hepatotoxicidad (icteri-cia).
• Trastornos del metabolismo y de la nutrición: Muy raras: Hipoglucemia.
• Trastornos de la sangre y del sistema linfático:
Muy raras: Trombocitopenia, agranulocitosis, leucopenia, neutropenia, anemia hemolítica.
• Trastornos vasculares: Raras: Hipotensión
• Trastornos renales y urinarios:
Muy raras: Piuria estéril (orina turbia), efectos renales adversos (Advertencias y precauciones especiales de empleo).
• Trastornos de la piel y el tejido subcutáneo.
Muy raras: Se han notificado reacciones cutáneas graves.
Inserto Dolex 500/650
(Archivo descargable)
(1) Inserto Tylenol. Food and Drug Administration. 2015. Disponible en:
https://www.accessdata.fda.gov/drugsatfda_docs/label/2015/204767s000lbl.pdf
(2) Massachusetts General Hospital. COVID-19 Treatment Guidance. Version 2.12 4/20/2020 2:00PM. Disponible en:
https://www.massgeneral.org/news/coronavirus/treatment-guidance
Conexion Paracetamol

Plasma de donante convaleciente
El plasma hiperinmune (es decir, «convaleciente») es plasma que se obtiene mediante plasmaféresis de los individuos después de la resolución de la infección y desarrollo de anticuerpos. Este plasma puede contener anticuerpos que podrían suprimir la viremia, por lo que puede ser una opción de tratamiento para pacientes con COVID-19. La terapia pasiva con anticuerpos, a través de la transfusión de plasma convaleciente, puede prevenir la infección clínica o disminuir la gravedad clínica en individuos con exposición reciente a patógenos. También puede ser utilizada para tratar a los pacientes sintomáticos con gravedad variada, aunque ha sido más efectiva cuando se administra profilácticamente o se utiliza en una etapa temprana de la aparición de los síntomas. (1,2)
Mecanismo de acción
Los anticuerpos presentes en el plasma convaleciente ejercen su efecto terapéutico a través de una variedad de mecanismos. Los anticuerpos pueden unirse a un patógeno, neutralizando así su infectividad directamente, o pueden actuar mediante la activación del sistema del complemento, la citotoxicidad celular dependiente de anticuerpos y/o la fagocitosis, la cual también puede contribuir a su efecto terapéutico. Mientras que los productos de plasma fraccionados (por ejemplo, globulina hiperinmune, anticuerpos monoclonales) y/o la vacunación pueden ofrecer opciones terapéuticas duraderas, el plasma humano anti-SARS-CoV-2 es la única estrategia terapéutica que se encuentra inmediatamente disponible para su uso para prevenir y tratar COVID-19. (2)
Estudios clínicos previos
SARS-1 y MERS
La administración pasiva de anticuerpos a través de la transfusión de plasma convaleciente puede ofrecer la única estrategia a corto plazo para conferir inmunidad inmediata a individuos susceptibles. Aunque aún no se ha demostrado que el plasma convaleciente sea un tratamiento eficaz para COVID-19, existen numerosos ejemplos en otros trastornos en los que el plasma convaleciente se ha utilizado con éxito como profilaxis posterior a la exposición y/o tratamiento en enfermedades infecciosas, incluidos otros brotes de coronavirus (por ejemplo, SARS-CoV-1 Síndrome Respiratorio del Medio Oriente [MERS]). La experiencia de esos brotes muestra que el plasma convaleciente contiene anticuerpos neutralizantes. El estudio más grande incluyó el tratamiento de 80 pacientes en Hong Kong con SARS. En comparación con aquellos pacientes a los que se le había dado plasma más tarde, los pacientes que fueron tratados antes del día 14 tuvieron resultados más satisfactorios, definidos como la obtención del alta hospitalaria antes del día 22, apoyando la administración temprana de plasma convaleciente para obtener un efecto óptimo. Datos limitados también sugirieron beneficio en pacientes gravemente enfermos: tres pacientes con infección por SARS-CoV-1 en Taiwán fueron tratados con plasma convaleciente, lo que resultó en una reducción en la carga viral, y los tres sobrevivieron. El tratamiento con plasma convaleciente también se informó en tres pacientes en Corea del Sur con MERS. (2)
COVID-19
El plasma convaleciente también se ha utilizado en la pandemia de COVID-19. Los datos limitados de China sugieren un beneficio clínico, incluida la resolución radiológica, la reducción de las cargas virales y una mejor supervivencia. Los datos de ensayos clínicos rigurosamente controlados de plasma convaleciente también son pocos, lo que subraya la necesidad de evaluar su uso de manera objetiva para un rango de indicaciones (por ejemplo, prevención versus tratamiento) y poblaciones de pacientes (por ejemplo, edad, enfermedad comórbida). (2)
En un estudio piloto con 10 pacientes con COVID-19 severo, los investigadores realizaron la trasfusión de plasma convaleciente, mostrando mejoras sintomácticas significativos en los días 1 a 3 luego de la trasfusión. También mostraron mejoría en las lesiones pulmonares verificada a través de radiografía. Además, un screening de 39 de 40 pacientes recuperados de COVID-19 mostró una valoración de anticuerpos neutralizantes ≥160. Una serie de casos de cinco pacientes enfermos en China también mostró mejora clínica luego de la trasfusión de plasma convaleciente (SARS-CoV-2 IgG>1000), con reducción de la carga viral, independencia de la ventilación mecánica, mejora en la oxigenación y estabilización clínica. (2,4)
Situación global
A nivel mundial, los centros de hemoderivados tienen la infraestructura necesria para realizar recolecciones y construir inventarios de plasma convaleciente para satisfacer la creciente demanda. No obstante, existen desafíos, tanto regulatorios como logísticos, que abarcan la elegibilidad y, el reclutamiento de donantes, las recolecciones y la propia transfusión. (2) Muchos centros de sangre están comenzando a recolectar plasma para abordar la pandemia de Coronavirus (COVID-19). (1)
La FDA ha emitido una guía para proporcionar recomendaciones a los hospitales e investigadores sobre la administración y el estudio del plasma convaleciente recolectado de individuos que se han recuperado del COVID-19 (plasma convaleciente COVID-19) durante la emergencia de salud pública. (3)
Protocolos de tratamiento
El protocolo de tratamiento del Hospital de John Hopkins, el protocolo de tratamiento de la Universidad de Washington proponen el plasma convaleciente como un tratamiento útil para COVID-19. (5,6) La guía de IDSA (Infectious Deseases Sociaty of America) menciona que, entre los pacientes que han ingresado en el hospital con COVID-19, se recomienda administrar plasma convaleciente COVID-19 en el contexto de un ensayo clínico. (7)
La plasmaféresis es el procedimiento estándar por el cual el plasma se separa de la sangre completa y se recoge. Los pacientes elegibles para participar en el programa de plasma convaleciente deben tener una prueba positiva para COVID-19, haberse recuperado de COVID-19, y haber permanecido sin síntomas durante al menos 28 días.1 En general, deficiencia de IgA, antecedentes de reacciones a la transfusión o a la sobrecarga de volumen son contraindicaciones. (7)
Estudios clínicos en curso, planificados y finalizados con COVID-19
Los estudios clínicos planificados, en curso y finalizados se encuentran disponibles en el siguiente link:
https://clinicaltrials.gov/ct2/results?cond=COVID&term=convalescent+plasma&cntry=&state=&city=&dist=
(1) National Institute of Health. Blood Donor Home Page. Type of Donations. Convalescent Plasma. Disponible en:
https://clinicalcenter.nih.gov/blooddonor/donationtypes/convalescent_plasma.html
(2) Bloch EM, Shoham S, Casadevall A, Sachais BS, Shaz B, Winters JL, van Buskirk C, Grossman BJ, Joyner M, Henderson JP, Pekosz A, Lau B, Wesolowski A, Katz L, Shan H, Auwaerter PG, Thomas D, Sullivan DJ, Paneth N, Gehrie E, Spitalnik S, Hod E, Pollack L, Nicholson WT, Pirofski LA, Bailey JA, Tobian AA. Deployment of convalescent plasma for the prevention and treatment of COVID-19. J Clin Invest. 2020 Apr 7. pii: 138745. doi: 10.1172/JCI138745.
(3) Food and Drug Administration (FDA). Recommendations for Investigational COVID-19 Convalescent Plasma. 13 de Abril del 2020. Disponible en:
https://www.fda.gov/vaccines-blood-biologics/investigational-new-drug-ind-or-device-exemption-ide-process-cber/recommendations-investigational-covid-19-convalescent-plasma
(4) Shen C, Wang Z, Zhao F, et al. Treatment of 5 Critically Ill Patients With COVID-19 With Convalescent Plasma. JAMA. 20 de Enero del 2020. doi: 10.1001/jama.2020.4783.
(5) Johns Hopkins Hospital. Coronavirus COVID-19 (SARS-CoV-2) | Johns Hopkins ABX Guide. Updated: March 30, 2020. Disponible en:
https://www.hopkinsguides.com/hopkins//view/Johns_Hopkins_ABX_Guide/540747/all/Coronavirus_COVID_19__SARS_CoV_2_?refer=true
(6) Universidad de Washington. COVID-19 Treatments. Disponible en:
https://covid.idea.medicine.uw.edu/page/treatment/drugs
(7) Infectious Deseases Sociaty of America (IDSA). Infectious Diseases Society of America Guidelines on the Treatment and Management of Patients with COVID-19. 11 de Abril del 2020. Disponible en:
https://www.idsociety.org/practice-guideline/covid-19-guideline-treatment-and-management/
Conexion Plasma Convaleciente
Linezolid
Linezolid es un antibiótico de clase oxazolidinona indicado en adultos y niños para el tratamiento de las siguientes infecciones causadas por bacterias Gram-positivas susceptibles: neumonía nosocomial; neumonía adquirida por la comunidad; infecciones complicadas de la piel y la estructura de la piel, incluidas las infecciones del pie diabético, sin osteomielitis concomitante; Infecciones sin complicaciones de la estructura de la piel y la piel (1.2); Infecciones de enterococcus faecium resistentes a la vancomicina. El producto en su presentación de inyectable fue aprobado en Estados Unidos por la FDA en el año 2000. (1,2)
La guía para el Manejo clínico de la infección respiratoria aguda (IRA) severa con COVID-19 de la OMS especifica que, para la sobreinfección bacteriana, se debe administrar antibioticoterapia empírica para tratar todos los patógenos probables que causan la IRA y/o sepsis lo antes posible, en un período de una hora desde la evaluación inicial del paciente, para pacientes con sepsis. El tratamiento antibiótico empírico debe basarse en el diagnóstico clínico (neumonía adquirida de la comunidad, neumonía asociada a la atención médica o sepsis), datos locales de epidemiología, susceptibilidad, y pautas nacionales de tratamiento. (3)
Siempre que sea posible etará indicada la realización de hemocultivos seriados, de acuerdo a la guía diagnóstica de cada Institución.
La guía de manejo clínico para personas ingresadas en el hospital con sospecha de infección por COVID-19 del Servicio Nacional de Salud (NHS, National Health Service) del Reino Unido, especifica que la infección bacteriana no es causada por agentes previsiblesen la infección bacteriana secundaria a COVID-19. El principal valor de los antibióticos será tratar las infecciones distintas aSars-CoV-2, ya sea antes de que esté disponible el resultado de la prueba RT-PCR, o debido a sospechas de sobreinfección. La elección del antibiótico debe seguir los protocolos locales para el tratamiento de infecciones respiratorias. La terapia empírica debe reducirse en función de los resultados de microbiología (hemocultivo) y la evaluación clínica. Para los pacientes en los que se confirma la infección por COVID-19 y no hay indicios de una infección bacteriana secundaria, se debe considerar la suspensión temprana de los antibióticos empíricos. (4)
La Guia de la Universidad de Washington menciona que los pacientes hospitalizados en China fueron tratados con frecuencia con antibióticos, aunque la verdadera incidencia de sobre-infección bacteriana no se ha caracterizado completamente. No recomendamos antibióticos de rutina para pacientes con COVID-19, a menos que haya otra indicación para los antibióticos. (5)
La guía de tratamiento del Massachusetts General Hospital (MGH) no recomienda los antibióticos empíricos de rutina. Hasta ahora, MGH ha detectado tasas bajas de sobreinfección bacteriana en pacientes con COVID-19. (6)
Las guías clínicas de los Centros de Control y Prevención de Enfermedades Infecciosas (CDC, Centers for Disease control and Prevention), IDSA (Infectious Deseases Society of America), la Sociedad Torácica Americana y del Hospital de Johns Hopkins no mencionan el uso de antibióticos.
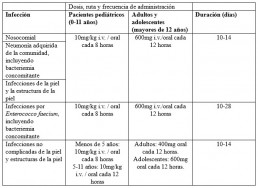
Dosis y administración (2)
Precauciones y advertencias (2)
• Mielosupresión: se recomienda realizar recuento de células sanguíneas completos enm forma diaria o con menor frecuencia. Considere la interrupción en pacientes que desarrollan o em-peoran la mielosupresión.
• Neuropatía periférica y óptica: notificada principalmente en pacientes tratados durante más de 28 días. Si los pacientes experimentan síntomas de discapacidad visual, se recomienda una evaluación oftálmica inmediata.
• Síndrome de serotonina: los pacientes que toman antidepresivos serotoninérgicos deben recibir Linezolida sólo si no hay otras terapias disponibles. Se recomienda suspender los antidepresivos serotoninérgicos y controlar a los pacientes en busca de signos y síntomas de síndrome de serotonina.
• Diarrea asociada a Clostridium difficile: evaluar si ocurre diarrea.
• Interacciones potenciales que producen elevación de la presión arterial, por lo que se recomienda monitorearla.
• Hipoglucemia: se han notificado casos posteriores a la comercialización de hipoglucemia sintomática en pacientes con diabetes mellitus que reciben insulina o agentes hipoglucemiantes orales.
Eventos adversos
Las reacciones adversas comunes incluyen: diarrea, vómitos, dolor de cabeza, náuseas y anemia.
(1) Food and Drug Administration (FDA). FDA Approved Drugs. Disponible en:
https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=021131
(2) Inserto Zyvox. Food and Drug Administration. 2018. Disponible en:
https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/021130s037,021131s030,021132s035lbl.pdf
(3) World Health Organization (WHO). Clinical management of severe acute respiratory infec-tion (SARI) when COVID-19 disease is suspected. Interim guidance V1.2. 13 March 2020. Disponible en:
https://www.who.int/publications-detail/clinical-management-of-severe-acute-respiratory-infection-when-novel-coronavirus-(ncov)-infection-is-suspected
(4) National Health Service (NHS). Specialty guides for patient management during the corona-virus pandemic. Clinical management of persons admitted to hospital with suspected COVID-19 infection. Publications approval reference: 001559.
(5) Universidad de Washington. COVID-19 Treatments. Disponible en:
https://covid.idea.medicine.uw.edu/page/treatment/drugs
(6) Massachusetts General Hospital. COVID-19 Treatment Guidance. Version 2.12 4/20/2020 2:00PM. Disponible en:
https://www.massgeneral.org/news/coronavirus/treatment-guidance
Conexion Linezolid
Estudios en monos Rhesus muestran protección ante una reinfección con SARS-CoV-2
La pandemia Covid-19 ha generado diversas interrogantes que la ciencia está trabajando por responder. Una de ellas es si la inmunidad adaptativa en el ser humano que ha sido infectado con SARS-CoV-2 es capaz de protegerlo ante un segundo encuentro con el virus. Para responder esta interrogante los científicos han realizados estudios en monos macacos, ya que éstos comparten un 99% de los genes con los seres humanos, y pueden servir por tanto como buenos predictores.
Bao y colaboradores han trabajado para resolver esta incógnita realizando estudios con 4 monos macacos Rhesus chinos adultos, de 3-5 años de edad y y 3-5 Kg. Estos monos fueron infectados con SARS-CoV-2 a dosis infectivas del 50% y se realizó seguimiento del peso corporal, temperatura, radiografías, extracciones de sangre y de exudado nasal, de garganta y anal. En la infección inicial 3 de los 4 monos mostraron pérdida de peso y apetito más no presentaron fiebre. La carga viral mostró su pico a los 3 días posteriores a la infección, y disminuyeron naturalmente.
Para identificar la distribución viral y los cambios histopatológicos, el mono 1 fue sometido a eutanasia luego de 7 días de la infección. Se observó presencia se SARS-CoV-2 en nariz, faringe, pulmón, intestino, médula espinal, corazón, músculo esquelético y vejiga. Como era de esperar, en el pulmón se observaron los principales daños con neumonía moderada con tabique alveolar delgado, acumulación de macrófagos en el alvéolo, degeneración del epitelio alveolar e infiltración de células inflamatorias.
En los monos 2,3 y 4 se observó que para los días 14, 21 y 28 después de la infección los anticuerpos anti-SARS-CoV-2 se encontraban significativamente elevados en comparación con los días 3 y 7 post-infección. Para el día 28 la carga viral nasofaríngea y anal resultó indetectable, y tampoco se encontraron anormalidades en las radiografías de pecho. Los tres monos se recuperaron, con dos resultados negativos para SARS-CoV-2 realizados por RT-PCR.
Posteriormente, los monos 3 y 4 fueron sometidos a una segunda infección con el virus, 28 días después, con la misma dosisi inicial; y el mono 2 se utilizó como control. Ninguno de los monos mostró pérdida de peso después de la re-infección, pero se vio una elevación de temperatura corporal transitoria. Más importante aún, los test para la carga viral mostraron ser negativos en todos los tiempos analizados luego de la re-infección. El mono 3 fue sometido a eutanasia a los 5 días de la segunda infección para evaluar nuevamente la replicación viral y los cambios histopatológicos; y los resultados se compararon con los encontrados anteriormente para el mono 1. En esta oportunidad no se halló carga viral ni daño tisular en ningún tejido. Para el mono 4 tampoco se vieron daños pulmonares a los 5 días ni a los 28 días luego de la re-infección. Estos resultados permiten sugerir que los monos recuperados de la infección con SARS-CoV-2 pudieron resistir una segunda re-infección.
Este estudio realizado por Bao y colaboradores tuvo una segunda actualización, donde utilizaron 7 monos macacos Rhesus chinos a los cuales infectaron son SARS-CoV-2. 28 días después, 4 monos fueron re-infectados y 3 monos fueron utilizados como control negativo. Los mismos resultados que en el estudio anterior fueron obtenidos, pero además en esta oportunidad analizaron glóbulos blancos, linfocitos y neutrófilos. En la primer infección los niveles de glóbulos blancos se vieron disminuidos y los linfocitos T se vieron estables. Anticuerpos específicos contra SARS-CoV-2 fueron en aumento gradual hasta alcanzar su nivel más alto el día 21. Para la segunda infección se volvió a ver un aumento transitorio de la temperatura corporal y un aumento en los anticuerpos anti-SARS-CoV-2 al día 14 de la reinfección, y de las células T a los días 5 y 7 luego de la reinfección. Estos hallazgos comprueban los resultados previos, donde los monos recuperados de una primer infección no resultaron infectados en un segundo encuentro con el virus 28 días después.
Los autores seguirán trabajando para investigar si los mismos resultados se suscitan con un período mas largo entre las infecciones (6 meses). Sin embargo estos resultados resultan alentadores, ya que los seres humanos y los monos Rhesus poseemos grandes similitudes y esto podría inferir que en humanos también es posible afrontar un segundo encuentro con el virus sin generar infección.
Bibliografía:
– Monkeys develop protective antibodies to SARS-CoV-2. The Scientist 2020. Extraído de:
https://www.the-scientist.com/news-opinion/monkeys-develop-protective-antibodies-to-sars-cov-2-67281
– Bao et al. Reinfection could not occur in SARS-CoV-2 infected rhesus macaques. bioRxiv. 2020.
https://www.biorxiv.org/content/10.1101/2020.03.13.990226v1
– Bao et al. Lack of Reinfection in Rhesus Macaques Infected with SARS-CoV-2. bioRxiv. 2020.
https://doi.org/10.1101/2020.03.13.990226
– Ota M. Will we see protection or reinfection in COVID-19? Nature Reviews Immunology. 2020.
https://doi.org/10.1038/s41577-020-0316-3
Conexion Megalabs - Monos con ac protectores covid19

IVERMECTINA: Un nuevo soldado contra la lucha de COVID-19.
Un estudio in vitro conducido por el Instituto Monash de Descubrimientos en Biomedicina (BID) y el Hospital Real de Melbourne de Australia, ha mostrado que Ivermectina es capaz de detener la replicación viral de SARS-CoV-2 en menos de 48 hs.
Previamente, mediante estudios in vitro, Ivermectina mostró ser efectivo contra diversos virus como VIH, Zika, Dengue e Influenza. Teniendo presente dichos hallazgos, Caly y colaboradores han decidido estudiar el comportamiento de este medicamento en células Vero-hSLAM infectadas previamente con SARS-CoV-2. Mediante PCR, luego de 24 horas de incubación con el medicamento se observó una reducción del 93% en la carga viral de ARN. A las 48hs de incubación con el medicamento se observó la pérdida efectiva de la carga viral esencial (disminuyendo más de 5.000 veces respecto a condiciones iniciales, 99.8%) en las células infectadas y en su sobrenadante. De esta forma Ivermectina mostró in vitro su acción antiviral para SARS-CoV-2 en una sola dosis, en un período de 24-48 hs.
¿Qué es Ivermectina y cómo inhibe SARS-CoV-2?
Se trata de un antiparasitario descubierto en la década de los años 70, que resultó revolucionario por su amplio espectro, al actuar contra nemátodos y artrópodos. Si bien inicialmente fue utilizado en animales, desde 1988 ha sido usado exitosamente en humanos, mejorando la nutrición y calidad de vida de billones de personas. Ha mostrado ser seguro, eficaz y bien tolerado para diversas infecciones parasitarias (en especial Oncocercosis).
Ivermectina es un inhibidor de la interacción entre las proteínas de la envoltura viral y la célula huésped. Los autores plantean que, de la misma forma que ocurre con VIH, Zika, Dengue e Influenza; Ivermetcin inhibe la importación viral al núcleo. Esto lo logra ya que interacciona con la proteína citosólica de importación nuclear IMPα/β1, e impide su unión con las proteínas de la cápside viral.
El uso de Ivermectina en la actualidad
Recientemente se obtuvieron los resultados preliminares de un estudio clínico con Ivermectina, donde 704 pacientes con Covid-19 fueron tratados con Ivermectina, a una dosis de 150ug/Kg. Por otra parte, otros 704 pacientes fueron incluidos para ser tratados con placebo. Se observó que la tasa de letalidad y la permanencia en el hospital fue menor para los pacientes tratados con Ivermectina, pero el autor declara que aún es necesario confirmar estos hallazgos mediante más estudios clínicos randomizados.
En República Dominicana, el Dr. Tavárez ha reportado que ha tratado varios pacientes con Ivermectina, y ha obtenido respuesta favorable en todos los casos, sin registrar casos fatales. De manera similar, en Perú también han tratado pacientes con Covid-19 con Ivermectina, con una mejoría del 100% y resolución de la fiebre dentro de las 48 horas de iniciado el tratamiento. En Perú, el Dr. Aguirre publicó el 02 de Mayo un artículo titulado “INCLUSIÓN DE LA IVERMECTINA EN LA PRIMERA LÍNEA DE ACCIÓN TERAPÉUTICA PARA COVID-19”, donde presenta un plan terapéutico para Covid-19 con Ivermectina, teniendo en consideración lo anteriormente mencionado. El autor expresa como conclusión que “Al no existir prácticamente riesgo en el uso de la Ivermectina, se recomienda formalizar su inclusión en la primera línea de acción terapéutica para COVID-19, para reducir la carga y replicación viral”.
Actualmente Ivermectina no está presente dentro de los medicamentos más evaluados en estudios clínicos, a pesar de sus resultados in vitro prometedores y su uso fuera de las indicaciones presuntamente exitosos. Los fármacos más estudiados son: Lopinavir/Ritonavir, Remdesivir, Cloroquina, Interferón, Hidroxicloroquina y Azitromicina.
Ivermectina está aprobado por FDA para su uso como antiparasitario en humanos y animales, pero aún no ha sido aprobado para su uso en Covid-19. Esta aprobación dependerá de los resultados de más pruebas preclínicas y clínicas que confirmen los resultados recientemente obtenidos. Este medicamento ya está disponible en todo el mundo; con lo cual, de ser aprobado para su tratamiento en COVID-19, su aplicación para COVID-19 podría ser inmediata.
Bibliografía:
– Periódico El Caribe. Medicamento ayuda a 150 con COVID19 en centro de Puerto Plata (20 Abril 2020). Disponible en:
https://www.elcaribe.com.do/2020/04/20/medicamentoayuda-a-150-con-covid-19-en-centro-de-puerto-plata/
– Aguirre G. inclusión de la Ivermectina en la primera línea de acción terapéutica para Covid-19. Mayo 2020. Perú.
– Ivermectin. FDA. 2020. Extraído de:
https://www.fda.gov/animal-veterinary/product-safety-information/faq-covid-19-and-ivermectin-intended-animals
IVERMECTINA Un nuevo soldado en la lucha contra COVID-19.

Vacunas en desarrollo para tratamiento de infecciones con SARS-CoV-2
Los primeros casos de infecciones por un virus respiratorio ocurrieron en China, en el último trimestre de 2019. La elevada capacidad replicativa e infectiva de este virus lo convirtió en epidemia y prontamente en pandemia. Fue el 11 de Enero de 2020 que se logró obtener la secuencia de este virus y caracterizarlo como SARS-CoV-2. Desde ese momento se desencadenó el desarrollo masivo de candidatos a vacunas para este virus, y fue el 16 de Marzo de 2020 cuando comenzó el primer estudio clínico para analizar la eficacia de una vacuna candidata basada en ARN.
La OMS mantiene actualizado el panorama de los candidatos de vacunas de Covid-19. Actualmente hay 5 vacunas candidatas siendo evaluadas en ensayos clínicos, y 71 vacunas candidatas en evaluación pre-clínica.. Si bien hay más vacunas candidatas, las mismas no se encuentren en estados de desarrollo e investigación previa a la etapa pre-clínica in vivo; o no han confirmado su etapa de desarrollo a las autoridades. Estados Unidos es responsable del 46% de la actividad del desarrollo de estas vacunas, China del 18%, el resto de Asia+ Australia del 18%, y Europa es responsable del 18% restante.
La diversidad del desarrollo en los tipos de vacunas se ha desplegado para poder utilizar la tecnología disponible para ganar la batalla contra el SARS-CoV-2. Los tipos de vacunas varían entre: virus vivos atenuados, inactivados, vectores virales no replicantes, vectores virales replicantes, proteínas recombinantes, basadas en péptidos, ADN y ARN. Algunos de estos tipos de vacunas no han sido aprobadas previamente como vacunas, pero se han utilizado en oncología y esto ha alentado a los científicos a explorar su aplicación en la vacuna para SARS-CoV-2. Las vacunas basadas en ADN y ARN ofrecen flexibilidad para manipular el antígeno y por tanto permiten realizar cambios en las mismas más prontamente. El antígeno que los desarrolladores de vacunas buscan neutralizar suele ser, para la mayoría de las candidatas, la proteína viral espiga (spike protein).
El desafío de desarrollar una vacuna para tratar esta pandemia no tiene precedentes, lo cual ha generado investigaciones clínicas y pre-clínicas a velocidades inimaginadas. Se cree que una vacuna para esta indicación podría estar disponible para comienzos del 2021; lo cual es extremadamente rápido dado el tiempo que se requiere usualmente (5-10 años aproximadamente). Estas vacunas candidatas deben ser evaluadas cuidadosamente para certificar la eficacia y seguridad en cada paso.
Bibliografía:
– Le et al. The Covid-19 vaccine development landscape. Nature.2020. Doi: 10.1038/d41573-020-00073-5
Conexion Megalabs - Nota Vacunas
Se descubre el primer anticuerpo de origen humano contra SARS-CoV-2
La pandemia ocasionada por SARS-CoV-2 ha generado que gran parte de la comunidad científica se avoque al descubrimiento de anticuerpos capaces de reconocer y neutralizar al virus. La búsqueda de nuevos anticuerpos eficaces contra SARS-CoV-2 tiene un rol crucial en la lucha contra la pandemia, y se suma a los esfuerzos para obtener una vacuna efectiva.
En el año 2003 surgió la pandemia con el virus SARS-CoV, que comparte aproximadamente el 70% de la secuencia genética con el virus SARS-CoV-2. Diversos anticuerpos capaces de neutralizar dicho virus fueron hallados, pero dado que no existían casos desde el año 2004, no se avanzó con sus análisis. En ese entonces se había descubierto que el anticuerpo monoclonal CR3022 era capaz de neutralizarlo a través de su unión con la proteína espiga viral. Recientemente se descubrió que dicho anticuerpo es capaz de neutralizar a SARS-CoV-2 al unirse a la proteína espiga del mismo, presente en la envoltura viral y que homóloga a la proteína espiga de SARS-CoV. Este anticuerpo tiene una característica particular, y es que no compite con el sitio de unión a la célula del receptor celular ACE2 (enzima convertidora de angiotensina I-2; como ocurre con otros anticuerpos), sino que impide estéricamente la unión entre el virus y el receptor ACE2, al unirse con la proteína espiga. Por tanto, este anticuerpo es un “neutralizante cruzado” que reconoce a los virus SARS-CoV y SARS-CoV-2. (1)
Actualmente se han tomado anticuerpos policlonales presentes en el suero de pacientes recuperados para Covid-19, para tratar la infección con SARS-CoV-2. Wang y colaboradores realizaron experimentos utilizando suero con anticuerpos de ratones transgénicos inmunizados. La muestra analizada poseía 51 hibridomas SARS-S que codificaban para inmunoglobulinas quiméricas rata: humano (cadena pesada variable humana, y cadena liviana y región constante de rata). De los 51 hibridomas analizados por la técnica ELISA, se vio que el anticuerpo quimérico 47D11-H2L2 tenía capacidad neutralizante cruzada SARS-CoV y SARS-CoV-2. Este candidato fue rediseñado hacia una composición completamente humana, al clonar la cadena pesada variable y la cadena liviana de una IgG humana. Este anticuerpo modificado biotecnológicamente, denominado 47D11, fue utilizado en posteriores análisis en células VeroE6 infectadas con ambos tipos de virus. Los resultados demostraron que el anticuerpo monoclonal 47D11 es capaz de inhibir potentemente la infección de virus SARS-Cov y SARS-CoV-2 en el cultivo celular estudiado, a través de un mecanismo aún no elucidado completamente, pero diferente al mecanismo empleado por otros anticuerpos como el impedimento estérico. El mecanismo probable planteado por los autores establece que es probable que la interacción con la proteína espiga genere la desestabilización viral y la perfusión de la estructura del virus. (2)
Se espera que se sigan descubriendo nuevos anticuerpos humanos contra SARS-CoV-2 y que sean sometidos a estudios in vitro e in vivo para demostrar la capacidad neutralizante (estudios preclínicos); y que posteriormente demuestren su eficacia en estudios clínicos.
Bibliografía:
2- Wang C et al. A human monoclonal antibody blocking SARS_CoV-2 infection. Nature. 2020. 11, 2251.
Conexion Megalabs -Se descubre el primer anticuerpo de origen humano contra SARS-CoV-2










