Índice de masa corporal y riesgo de hospitalización por COVID-19, admisión a la unidad de cuidados intensivos, ventilación mecánica invasiva y muerte
Lyudmyla Kompaniyets, PhD¹,²; Alyson B. Goodman, MD¹; Brook Belay, MD¹,²; David S. Freedman, PhD¹; Marissa S. Sucosky, MPH¹; Samantha J. Lange, MPH¹; Adi V. Gundlapalli, MD, PhD²; Tegan K. Boehmer, PhD²; Heidi M. Blanck, PhD
Centers for Disease Control and Prevention (USA)
https://www.cdc.gov/mmwr/volumes/70/wr/mm7010e4.htm?s_cid=mm7010e4_w
Resumen
¿Qué se sabe ya sobre este tema?
La obesidad aumenta el riesgo de enfermedad grave asociada a COVID-19.
¿Qué agrega este informe?
Entre 148.494 adultos estadounidenses con COVID-19, se encontró una relación no lineal entre el índice de masa corporal (IMC) y la gravedad de COVID-19, con riesgos más bajos en IMC cerca del umbral entre peso saludable y sobrepeso en la mayoría de los casos, y aumentando con un IMC más alto. El sobrepeso y la obesidad fueron factores de riesgo para la ventilación mecánica invasiva. La obesidad fue un factor de riesgo de hospitalización y muerte, especialmente entre los adultos menores de 65 años.
¿Cuáles son las implicaciones para la práctica de la salud pública?
Estos hallazgos destacan las implicaciones clínicas y de salud pública de IMC más altos, incluida la necesidad de un manejo del COVID-19 grave en unidad de cuidados intensivos, la priorización continua de las vacunas y el uso de máscaras, y políticas para apoyar comportamientos saludables.
Introducción
La obesidad es un factor de riesgo reconocido para el COVID-19 grave, posiblemente relacionado con la inflamación crónica que interrumpe las respuestas inmunes y trombogénicas a los patógenos, así como con la función pulmonar deteriorada por el exceso de peso. La obesidad es una enfermedad metabólica común que afecta al 42,4% de los estadounidenses adultos, y es un factor de riesgo para otras enfermedades crónicas, incluida la diabetes tipo 2, enfermedades cardíacas y algunos cánceres. El Comité Asesor sobre Prácticas de Inmunización considera que la obesidad es una afección médica de alto riesgo para la priorización de la vacuna COVID-19. Utilizando datos de “Premier Healthcare Database Special COVID-19 Release” (PHD-SR), los Centros para el Control y Prevención de Enfermedades (CDC) evaluaron la asociación entre el índice de masa corporal (IMC) y el riesgo de resultados graves de COVID-19 (es decir, hospitalización, ingreso en la unidad de cuidados intensivos [UCI] o en la unidad de cuidados intermedios, ventilación mecánica invasiva y muerte. Entre 148.494 adultos que recibieron un diagnóstico de COVID-19 durante una visita al departamento de emergencias (DE) o como paciente hospitalizado en uno de 238 hospitales de Estados Unidos durante marzo – diciembre de 2020, el 28,3% tenía sobrepeso y el 50,8% tenía obesidad.
El sobrepeso y la obesidad fueron factores de riesgo para la ventilación mecánica invasiva y la obesidad fue un factor de riesgo de hospitalización y muerte, particularmente entre los adultos menores de 65 años. Los riesgos de hospitalización, ingreso en la UCI y muerte fueron más bajos entre los pacientes con IMC de 24,2 kg / m2, 25,9 kg / m² y 23,7 kg / m², respectivamente, y luego aumentaron drásticamente con IMC más altos. El riesgo de ventilación mecánica invasiva aumentó en todo el rango de IMC, de 15 kg / m2 a 60 kg / m². A medida que los médicos desarrollan planes de atención para los pacientes con COVID-19, deben considerar el riesgo de resultados graves en pacientes con IMC más altos, especialmente para aquellos con obesidad severa. Estos hallazgos destacan las implicaciones clínicas y de salud pública de un IMC más alto, incluida la necesidad de un manejo intensivo de la enfermedad COVID-19 a medida que aumenta la gravedad de la obesidad, la promoción de estrategias de prevención de COVID-19 que incluyen la priorización continua de vacunas y políticas para garantizar el acceso de la comunidad a la nutrición y las actividades físicas que promueven y apoyan un IMC saludable.
Los datos para este estudio se obtuvieron de PHD-SR, una gran base de datos hospitalaria. Entre los aproximadamente 800 hospitales geográficamente dispersos de EE. UU. que informaron datos tanto de pacientes hospitalizados como de urgencias a esta base de datos, 238 informaron sobre la altura y el peso de los pacientes y fueron seleccionados para este estudio. La muestra incluyó pacientes ≥18 años con talla y peso medidos y un servicio de urgencias o un encuentro hospitalario con un código de la Clasificación Internacional de Enfermedades, Décima Revisión, Modificación Clínica (ICD 10-CM) de U07.1 (COVID-19, virus identificado) durante el 1 de abril al 31 de diciembre de 2020 o B97.29 (otros coronavirus como causa de enfermedades clasificadas en otra parte; recomendado antes del lanzamiento de U07.1 de abril de 2020) durante el 1 de marzo al 30 de abril de 2020. El IMC se calculó usando alturas y pesos medidos durante el encuentro de atención médica más cercano al servicio de urgencias del paciente o encuentro en el hospital para COVID-19 en la base de datos. El IMC se clasificó en las siguientes categorías: bajo peso (<18,5 kg / m²), peso saludable (18,5-24,9 kg / m²), sobrepeso (25-29,9 kg / m²) y obesidad (cuatro categorías: 30-34,9 kg / m², 35 39,9 kg / m², 40-44,9 kg / m² y ≥45 kg / m²).
Entre 3.242.649 pacientes de ≥18 años con altura y peso documentados que recibieron atención en urgencias o atención hospitalaria en 2020, un total de 148.494 (4,6%) tenían códigos ICD-10-MC que indicaban un diagnóstico de COVID-19. Entre 71.491 pacientes hospitalizados con COVID-19 (48,1% de todos los pacientes con COVID-19), 34.896 (48,8%) requirieron ingreso en UCI, 9.525 (13,3%) necesitaron ventilación mecánica invasiva y 8.348 (11,7%) fallecieron. Aproximadamente el 1,8% de los pacientes tenían bajo peso, el 28,3% tenían sobrepeso y el 50,8% tenían obesidad. En comparación con la cohorte total de PHD-SR, los pacientes con enfermedad asociada a COVID-19 eran mayores (mediana de edad de 55 años frente a 49 años) y tenían una prevalencia bruta más alta de obesidad (50,8% frente a 43,1%).
La obesidad fue un factor de riesgo tanto para la hospitalización como para la muerte, y mostró una relación dosis-respuesta con el aumento de la categoría de IMC: las razones de riesgo ajustadas para la hospitalización variaron de 1,07 (intervalo de confianza del 95% [IC = 1,05 1,09]) para pacientes con un IMC de 30-34,9 kg / m² a 1,33 (IC del 95% = 1,30–1,37) para pacientes con un IMC ≥45 kg / m², en comparación con aquellos con un IMC de 18,5–24,9 kg / m² (peso saludable); las razones de riesgo ajustadas para la muerte variaron de 1.08 (IC del 95% = 1.02-1.14) para aquellos con un IMC de 30-34.9 kg / m² a 1.61 (IC del 95% = 1.47-1.76) para aquellos con un IMC ≥45 kg / m². La obesidad severa se asoció con el ingreso en la UCI, con razón de riesgo ajustada de 1.06 (IC del 95% = 1.03-1.10) para pacientes con un IMC de 40-44.9 kg / m² y 1.16 (IC del 95% = 1.11-1.20) para aquellos con un IMC ≥ 45 kg / m². El sobrepeso y la obesidad fueron factores de riesgo para la ventilación mecánica invasiva, con razón de riesgo ajustada de 1,12 (IC del 95% = 1,05-1,19) para un IMC de 25-29,9 kg / m² a 2,08 (IC del 95% = 1,89-2,29) para un IMC ≥ 45 kg / m². Las asociaciones con el riesgo de hospitalización y muerte fueron pronunciadas entre los adultos menores de 65 años: las razones de riesgo ajustadas para los pacientes en la categoría de IMC más alta (≥45 kg / m²) en comparación con los pacientes con peso saludable fueron de 1,59 (IC del 95% = 1,52-1,67) para la hospitalización y 2,01 (IC del 95% = 1,72-2,35) para la muerte.
Los pacientes con COVID-19 con bajo peso tenían un 20% (IC del 95% = 16% 25%) de mayor riesgo de hospitalización que aquellos con un peso saludable. Los pacientes <65 años con bajo peso tenían un 41% (IC del 95% = 31% -52%) más de probabilidades de ser hospitalizados que aquellos con un peso saludable, mientras que los pacientes ≥65 años con bajo peso tenían un 7% (IC del 95% = 4% -10%) más de probabilidades de ser hospitalizados.
Se observó una relación en forma de J (no lineal) entre el IMC continuo y el riesgo de tres resultados. El riesgo de hospitalización, ingreso en la UCI y muerte fueron más bajos con IMC de 24,2 kg / m², 25,9 kg / m² y 23,7 kg / m², respectivamente, y luego aumentaron drásticamente con IMC más altos. El riesgo estimado de ventilación mecánica invasiva aumentó en todo el rango de IMC, de 15 kg / m² a 60 kg / m². Los riesgos estimados de hospitalización y muerte fueron consistentemente más altos para los grupos de mayor edad; sin embargo, dentro de cada grupo de edad, el riesgo aumenta con un IMC más alto (ver Figura 1).
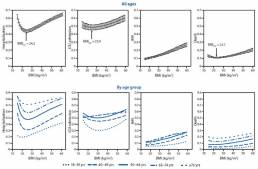
Figura 1: Riesgo estimado de enfermedad grave asociada a COVID-19 entre adultos de 18 años o más, por índice de masa corporal (IMC) y grupo de edad. Abreviaturas: UCI = unidad de cuidados intensivos o unidad de cuidados intermedios; IMV = ventilación mecánica invasiva.
Un análisis de sensibilidad mostró asociaciones más débiles entre la categoría de IMC y la enfermedad grave asociada a COVID-19 cuando se ajustó por otras afecciones médicas subyacentes, particularmente entre pacientes de 65 años o más.

Discusión
La mitad (50,8%) de los pacientes adultos con COVID-19 en este análisis tenían obesidad, en comparación con el 43,1% en la muestra total de PHD-SR y el 42,4% a nivel nacional, lo que sugiere que los adultos con COVID-19 y obesidad pueden recibir atención aguda en los servicios de urgencias u hospitales con mayor frecuencia. Los hallazgos de este informe son similares a los de estudios anteriores que indican un mayor riesgo de enfermedad grave asociada a COVID-19 entre personas con exceso de peso y brindan información adicional sobre una relación dosis-respuesta entre un IMC más alto y el riesgo de hospitalización, ingreso a la UCI, ventilación mecánica invasiva y muerte. El hallazgo de que el riesgo de enfermedad grave asociada a COVID-19 aumenta con un IMC más alto sugiere que podría ser necesario un manejo progresivamente intensivo de COVID-19 para pacientes con obesidad más grave. Este hallazgo también apoya la hipótesis de que la inflamación por exceso de adiposidad podría ser un factor en la gravedad de la enfermedad asociada a COVID-19. La asociación positiva encontrada entre el bajo peso y el riesgo de hospitalización podría explicarse por condiciones médicas subyacentes no detectadas o por deficiencias en la disponibilidad de nutrientes esenciales y la respuesta inmune.
De acuerdo con estudios anteriores, la relación dosis-respuesta entre el riesgo de hospitalización o muerte y un IMC más alto fue particularmente pronunciada entre los pacientes <65 años. Sin embargo, a diferencia de estudios previos que demostraron poca o ninguna asociación entre la obesidad y la gravedad del COVID-19 entre los pacientes mayores, los resultados de este informe indican que el sobrepeso y la obesidad son factores de riesgo para la ventilación mecánica invasiva y que la obesidad o la obesidad severa son factores de riesgo de hospitalización, ingreso en UCI y muerte en pacientes ≥65 años.
El IMC es de naturaleza continua, y los análisis en este informe describen una asociación en forma de J entre el IMC y el COVID-19 severo, con el riesgo más bajo en IMC cerca del umbral entre peso saludable y sobrepeso en la mayoría de los casos. El riesgo de ventilación mecánica invasiva aumentó en todo el rango de IMC, posiblemente debido al deterioro de la función pulmonar asociada con un IMC más alto. Estos resultados resaltan la necesidad de promover y apoyar un IMC saludable, que podría ser especialmente importante para las poblaciones afectadas de manera desproporcionada por la obesidad, en particular los adultos hispanos o latinos y los negros no hispanos y las personas de hogares de bajos ingresos, que son poblaciones que tienen una mayor prevalencia de obesidad y es más probable que tengan peores resultados de COVID-19 en comparación con otras poblaciones.
Los hallazgos de este estudio están sujetos a al menos cinco limitaciones. Primero, las estimaciones de riesgo de enfermedad grave asociada a COVID-19 (incluida la hospitalización) se midieron solo entre los adultos que recibieron atención en un hospital; por lo tanto, estas estimaciones pueden diferir del riesgo entre todos los adultos con COVID-19. En segundo lugar, las estimaciones del riesgo de hospitalización podrían haberse visto afectadas por el sesgo introducido por factores de ingreso hospitalario distintos de la gravedad de COVID-19, como la anticipación de un profesional de la salud de la gravedad futura. En tercer lugar, solo se incluyeron pacientes con información de peso y altura informada; entre 238 hospitales, al 28% de los pacientes les faltaba información sobre la altura, el peso o ambos. Sin embargo, los resultados de un análisis de sensibilidad que utilizó la imputación múltiple de los IMC faltantes fueron consistentes con los hallazgos primarios. En cuarto lugar, es posible que el IMC de algunos adultos mayores se haya clasificado erróneamente debido a interacciones complejas entre la pérdida de estatura y la sarcopenia, una afección caracterizada por la pérdida de masa y función del músculo esquelético. Finalmente, aunque este análisis incluye una de las muestras más grandes de pacientes con alturas y pesos disponibles para evaluar hasta la fecha, los resultados no son representativos de toda la población de pacientes de EE. UU.
Los hallazgos de este informe destacan una relación dosis-respuesta entre un IMC más alto y una enfermedad grave asociada a COVID-19 y subrayan la necesidad de un manejo progresivamente intensivo de la enfermedad a medida que aumenta la gravedad de la obesidad. Se necesitan estrategias continuas para garantizar el acceso de la comunidad a oportunidades de nutrición y actividad física que promuevan y apoyen un IMC saludable. La prevención de COVID-19 en adultos con IMC más altos y sus contactos cercanos sigue siendo importante e incluye medidas de protección multifacéticas como el uso de mascara facial, así como la priorización continua de vacunas y la divulgación para esta población.
El 8 de marzo de 2021, este informe se publicó como Publicación anticipada de “Morbidity and Mortality Weekly Report” MMWR en el sitio web de MMWR (https://www.cdc.gov/mmwr).
Referencia:
Kompaniyets L, Goodman AB, Belay B, Freedman DS, Sucosky MS, Lange SJ, Gundlapalli AV, Boehmer TK, Blanck HM, Tomado de:
https://www.cdc.gov/mmwr/volumes/70/wr/mm7010e4.htm?s_cid=mm7010e4_w
Índice de masa corporal y riesgo de COVID-19

Varios países europeos detienen el uso de la vacuna AstraZeneca debido a reportes de trombosis en personas vacunadas.
Dinamarca, Islandia y Noruega, son los países que, a la fecha, han suspendido el uso de la vacuna Oxford-AstraZeneca, mientas que la Agencia Europea del Medicamento, investiga si la vacunación puede estar relacionada con varios informes de formación de coágulos de sangre.
Dinamarca suspendió la vacunación con la vacuna de AstraZeneca, durante dos semanas como medida de precaución. Las autoridades sanitarias hacen énfasis en la importancia de obtener el mayor número de vacunas posibles, y afirman que existe evidencia de que la vacuna de AstraZeneca es segura y efectiva. Sin embargo, la decisión se ha tomado para responder de forma oportuna frente a efectos adversos graves.
Las autoridades sanitarias de Islandia informaron que en su país no ha habido informes de formación de coágulos, pero tomaron la decisión de suspender la vacunación por tiempo indefinido, a priori, a la espera de informes de la agencia reguladora de medicamentos. Destacan que la mayor preocupación es la falta de datos.
El Instituto Noruego de Salud informo por su parte, que se habían reportado casos de formación de coágulos de sangre, luego de recibir la vacuna, principalmente en población mayor de edad, que frecuentemente presentan otras patologías. La decisión de pausar la vacunación se tomo tras el informe de una muerte producto de coágulo en sangre, en Dinamarca.
Austria suspendió durante el fin de semana el uso de ese mismo lote después de que aparecieran coágulos sanguíneos graves en varias personas que recibieron esas dosis. Una persona murió 10 días después de la vacunación. Otro ahora se está recuperando después de haber sido hospitalizado.
Estonia, Lituania, Luxemburgo y Letonia siguieron el ejemplo de Austria al suspender el uso de ese lote, aunque continuarán vacunando a sus ciudadanos con dosis de AstraZeneca de otros lotes.
Varios países de la Unión Europea (UE) han excluido el uso de un lote particular de vacunas de AstraZeneca, luego de la muerte por trombosis múltiple de una mujer en Austria. La Agencia Europea del Medicamento informó que aproximadamente se había entregado 1 millón de dosis de ese lote, a 17 países de la UE.
Hasta el miércoles, se habían reportado 30 casos de coágulos sanguíneos obstructivos entre casi cinco millones de personas vacunadas con la vacuna AstraZeneca en la Unión Europea y otros tres países europeos, una tasa no más alta que en la población general, dijo la Agencia Europea de Medicamentos. La agencia, el principal regulador de medicamentos de Europa, dijo que los beneficios de la vacuna superan el riesgo.
La agencia también dijo que no hay indicios de que la vacuna «haya causado estas condiciones».
Gonzalo Viña, portavoz de AstraZeneca, dijo que los datos de la empresa no han revelado tales problemas de seguridad. “Un análisis de nuestros datos de seguridad de más de 10 millones de registros no ha mostrado evidencia de un mayor riesgo de embolia pulmonar o trombosis venosa profunda en ningún grupo de edad definido, género, lote o en ningún país en particular”, dijo.
Los coágulos de sangre, especialmente si son grandes, pueden dañar tejidos u órganos como los pulmones, el corazón o el cerebro. Los casos graves pueden ser fatales, pero las personas con coágulos pequeños a menudo pueden tratarse fuera del hospital con medicamentos de prescripción
Daniel Salmon, director del Instituto para la Seguridad de las Vacunas de la Universidad Johns Hopkins, dijo que las autoridades al notar los casos e investigarlos están dando una señal de que el sistema está funcionando como debería. «No sacaría conclusiones apresuradas de que debido a que hubo algunos coágulos de sangre después de la vacunación, son causales», dijo; «Merece analizarlo con más detalle».
Por su parte, AstraZeneca dijo en un comunicado que la seguridad de los pacientes es su máxima prioridad. La seguridad de la vacuna se ha estudiado en ensayos clínicos de fase III, donde se confirma que generalmente es bien tolerada. Además, afirman que los reguladores sanitarios de cada país tienen estándares claros y estrictos de eficacia y seguridad para la aprobación de cualquier medicamento nuevo.
La preocupación por la seguridad es un revés muy reiterado para la vacuna de AstraZeneca, que ya ha tenido problemas con la percepción de que es una inyección menos deseable porque en los ensayos clínicos tuvo una tasa de eficacia general más baja que otras. Sin embargo, existen numerosos datos que muestran que la vacuna es segura y eficaz, y especialmente buena para prevenir enfermedades graves y la muerte. Y en muchos lugares del mundo, es la única vacuna disponible.
Si bien los reportes de farmacovigilancia que involucran a la vacuna de AstraZéneca pueden no ser suficientes para demostrar causalidad, debería notarse que no se ha descrito algo similar para las vacunas que se administran en los Estados Unidos. La vacuna de AstraZeneca no ha recibido aún la aprobación de FDA y por lo tanto no se emplea en ese país.
Más información en:
https://www.nytimes.com/2021/03/11/business/astrazeneca-vaccine-denmark-blood-clots
Países de europa detienen la vacunación con astrazeneca

Covid-19: se necesitará una dosis de vacuna de refuerzo en otoño para evitar el aumento de casos en invierno, según el asesor del gobierno en Reino Unido.
The British Medical Journal, 2021; 372 doi: https://doi.org/10.1136/bmj.n664
(Publicado 09 Marzo 2021)
Es probable que se implemente una vacuna de refuerzo contra covid-19 en otoño para evitar otro aumento durante el invierno, dijo a The BMJ el vicepresidente del comité asesor de vacunas.
Al hablar en el podcast Talk Evidence de The BMJ, Anthony Harnden, del Comité Conjunto de Vacunación e Inmunización, dijo que creía que el refuerzo será necesario para proteger contra una nueva variante o como red de seguridad, ya que se desconoce la duración de la protección.
“Ciertamente no queremos ver un invierno como el que hemos visto este año. Y si tenemos nuevas variantes circulando y niveles de inmunidad decrecientes debido a la vacunación, entonces es imperativo hacer un refuerzo”, dijo Harnden, y agregó que el refuerzo puede administrarse a ciertos grupos vulnerables o a toda la población.
Añadió: «Creo que es probable que tomemos una decisión audaz de recomendar una dosis de refuerzo, incluso si no tenemos toda la evidencia de su necesidad, sólo porque creo que las consecuencias de no inmunizar con la dosis de refuerzo son muy graves. Si se demuestra meses después que es necesario, puede que sea demasiado tarde «.
Sugirió que el refuerzo podría implementarse en agosto o septiembre «en lugar de más adelante en el año, debido a esta preocupación por una gran tercera ola que afecte a los adultos mayores vulnerables».
Vacunación anual
Durante la entrevista, Harnden también abordó la cuestión de si la vacuna covid-19 podría convertirse en una vacuna anual, como el programa contra la gripe.
«Sospecho que es probable que necesitemos un refuerzo anual durante un tiempo», dijo. “Depende simplemente de la duración de la protección. El virus muta, pero probablemente no mute tanto ni tan rápido como el virus de la influenza, por lo que es muy difícil predecir si será una vacuna anual o cada cuántos años. «Pero ciertamente creo que habrá una inyección de refuerzo este año».
El Reino Unido ha informado más de 4,2 millones de casos de covid-19 y alrededor de 125 000 muertes, la mayoría de las cuales ocurrió en el segundo semestre de 2020 y a principios de 2021.
Referencias:
Mahase E. Covid-19: Booster dose will be needed in autumn to avoid winter surge, says government adviser BMJ 2021; 372 :n664 doi:10.1136/bmj.n664
Covid-19-se necesitará una dosis de vacuna de refuerzo-CF
Cambios en las arrugas y los poros de la piel debido al uso prolongado de mascarilla
Skin Res Technol. 2021 Feb 27.
https://pubmed.ncbi.nlm.nih.gov/33638266/
Dada la capacidad de las mascarillas para prevenir infecciones, se recomienda el uso de mascarillas en muchos países y se ha convertido en una necesidad en la vida diaria. Sin embargo, se han reconocido varias reacciones cutáneas adversas a las máscaras durante la pandemia de COVID-19 en curso. Se han informado varios trastornos de la piel relacionados con las mascarillas, que incluyen eritema, pápulas, pústulas, acné mecánico y dermatitis de contacto. Muchas personas, incluidos los trabajadores de la salud, que usan mascarillas durante largos períodos de tiempo, experimentan reacciones cutáneas, como erupción, picazón, piel seca y acné.
Existe una percepción cada vez mayor de que las mascarillas afectan la piel y hay un interés creciente en cómo se puede evitar el daño cutáneo relacionado con las mascarillas. Un estudio reciente encontró que el uso de mascarillas a corto plazo afecta las características de la piel, y es probable que estos efectos se vuelvan más pronunciados cuando se usa una mascarilla por períodos más prolongados. Hasta donde sabemos, no se ha realizado ningún estudio del efecto del uso de mascarillas a largo plazo sobre las arrugas y los poros de la piel. Actualmente, las medidas preventivas más efectivas son el uso de una máscara, una higiene personal meticulosa y el distanciamiento social. Además, con el aumento de los contaminantes del aire, incluido el polvo fino, ultrafino y amarillo, es probable que el uso de mascarillas a largo plazo, acompañado de cambios en las características de la piel, se vuelva más común en el futuro.
Dada la naturaleza prolongada de la actual pandemia de COVID-19, este estudio investigó los cambios en las arrugas y los poros de la piel causados por el uso de mascarillas a largo plazo y si el uso de una crema hidratante tiene o no un efecto sobre los cambios.
Materiales y Métodos
Participantes del estudio y tratamiento
Las participantes del estudio fueron 20 mujeres coreanas sanas de una edad media de 50,1 años (rango de 20 a 60) sin enfermedades de la piel ni antecedentes de piel sensible. Las mujeres eran elegibles para su inclusión en el estudio si podían usar una mascarilla durante al menos 6 horas al día durante 4 semanas, excepto cuando dormían y durante las comidas. La máscara que se usó fue la máscara protectora contra el polvo fino Dr Pepstory KF94 (EDL, Gyeonggi-do, Corea). Los participantes del estudio mantuvieron un registro escrito de su uso diario de mascarillas durante el período de estudio de 4 semanas.
Medición de arrugas cutáneas
Las arrugas de la piel en los pliegues nasolabiales en ambos lados de la cara (parte del área de la piel cubierta por una máscara) se contaron usando un dispositivo PRIMOS lite (LMI Technologies GmbH, Berlín, Alemania). La gravedad de las arrugas en el área del pliegue nasolabial se evaluó midiendo el valor de rugosidad de la piel (Ra) utilizando el software PRIMOS 5.7.
Medición de los poros de la piel
Los poros de la piel se midieron utilizando un sistema Antera 3D® CS (Miravex, Dublín, Irlanda). Se obtuvieron medidas para las mejillas, las cuales están cubiertas cuando se usa una máscara. El área de poros de la piel en el área seleccionada se calculó después de convertir las imágenes al modo “Pores_small” usando el software Antera 3D®.
Evaluación de los efectos de una crema hidratante
El efecto de la aplicación de un humectante sobre las arrugas y los poros de la piel se investigó de la siguiente manera: el área de uso de la mascarilla se dividió en un lado izquierdo, donde no se aplicó humectante (grupo A1), y un lado derecho, en el que se aplicó un humectante facial (grupo A2). Luego, los participantes usaron sus máscaras como se les indicó. La crema hidratante (Physiogel; Stiefel Laboratories, Sligo, Irlanda) se aplicó en el lado derecho de la cara dos veces al día (mañana y noche) durante 4 semanas.
Los participantes del estudio visitaron el Centro de Ensayos Clínicos de la Piel antes y después de 4 semanas de uso de la mascarilla. En cada visita, las medidas del estudio se obtuvieron después de 30 min de estabilización en una habitación con una temperatura controlada de 22 ± 2 ° C y una humedad relativa de 50 ± 10% y evitando el flujo de aire directo y la luz solar.
Cuestionario
En la segunda visita, todos los participantes del estudio completaron un cuestionario sobre los efectos del uso prolongado de mascarillas sobre las arrugas y los poros de la piel. Cada ítem se evaluó subjetivamente en una escala de 4 puntos (1, muy malo; 2, malo; 3, bueno; 4, muy bueno). Los participantes respondieron a los dos cuestionarios relativos al grupo A1 y A2. El cuestionario también preguntó a los participantes del estudio si creían o no que el uso de mascarillas a largo plazo afectaría su piel. Las mujeres respondieron esta pregunta utilizando una escala de 4 puntos (1, totalmente en desacuerdo; 2, en desacuerdo; 3, de acuerdo; 4, totalmente de acuerdo).
Análisis estadístico
Después de que se confirmó la normalidad de los datos, se compararon los cambios en las arrugas y los poros de la piel después del uso prolongado de la máscara mediante la prueba t apareada. Los grupos A1 y A2 se compararon mediante la prueba t independiente. Los resultados de las arrugas y los poros de la piel se resumen como la media y la desviación estándar. Los resultados de cada elemento del cuestionario se muestran como porcentajes. Todos los análisis estadísticos se realizaron utilizando SPSS Statistics versión 25 (IBM Corp., Armonk, NY, EE. UU.). Un valor de p <0,05 se consideró estadísticamente significativo.
RESULTADOS
Las 20 mujeres (edad media, 50,10 ± 5,78 años) completaron el estudio. La máscara se usó durante un promedio de 7,05 ± 0,73 horas por día durante el período de estudio de 4 semanas.
El valor de Ra para las arrugas cutáneas aumentó un 3,21% en el grupo A1 después de 4 semanas de uso de la máscara, pero disminuyó un 4,68% en el grupo A2 (Figura 1). El área de los poros de la piel aumentó un 11,21% en el grupo A1 después de 4 semanas de uso de la mascarilla y disminuyó un 3,10% en el grupo A2 (Figura 2). Las diferencias entre los grupos en la rugosidad de la piel y el área de los poros de la piel fueron estadísticamente significativas (Figura 3).

Figura 1: Las arrugas de la piel se midieron antes y después de 4 semanas de uso de la mascarilla. ** P <.01, *** P <.001, después vs antes de 4 semanas de uso de la mascarilla. A1, área de la piel del rostro cubierta por la mascarilla donde no se aplicó humectante. A2, área de la piel del rostro cubierta por la mascarilla donde se aplicó la crema hidratante
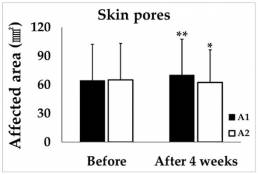
Figura 2: Se midieron los poros de la piel después de 4 semanas de uso de la máscara. * P <.05, ** P <.01, después vs antes de 4 semanas de uso de la mascarilla. A1, área de la piel del rostro cubierta por la mascarilla donde no se aplicó humectante. A2, área de la piel del rostro cubierta por la mascarilla donde se aplicó la crema hidratante
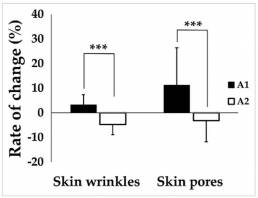
Figura 3: Cambios en las arrugas y los poros de la piel después de 4 semanas de uso de la mascarilla. *** P <0,001, A1 frente a A2. A1, área de la piel del rostro cubierta por la mascarilla donde no se aplicó humectante. A2, área de la piel del rostro cubierta por la mascarilla donde se aplicó la crema hidratante
Según los resultados del cuestionario, el 55,00% de las mujeres del grupo A1 y el 5,00% de las del grupo A2 notaron que sus arrugas cutáneas habían empeorado durante el período de estudio, mientras que el 30,00% y el 10,00%, respectivamente, calificaron los poros de su piel como más grandes. El ochenta por ciento de los participantes del estudio estuvo de acuerdo con la afirmación de que el uso prolongado de mascarillas afectaba su piel (Figura 4).
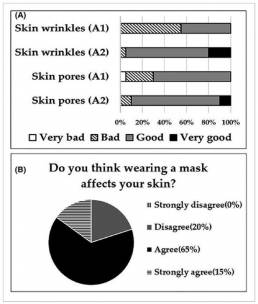
Figura 4: Resultados de un cuestionario subjetivo de evaluación de los cambios en las arrugas y los poros de la piel después de 4 semanas de uso de la máscara (A.) Respuestas a preguntas sobre cambios en la piel debido al uso prolongado de mascarillas (B). Respuestas a las preguntas sobre si los participantes del estudio creían o no que el uso de mascarillas a largo plazo afectaría su piel (B). A1, área de la piel del rostro cubierta por la mascarilla donde no se aplicó humectante. A2, área de la piel del rostro cubierta por la mascarilla donde se aplicó la crema hidratante
DISCUSIÓN
En este estudio, hubo un aumento en las mediciones objetivas de las arrugas y los poros de la piel en áreas de la piel del rostro donde no se aplicó humectante.
Las razones probables para el aumento de las arrugas de la piel son que la piel se vuelve áspera en respuesta a la fricción creada por el uso prolongado de la mascarilla y el secado de la piel como resultado de un aumento de la temperatura de la piel en el área cubierta por la mascarilla.
El factor que contribuye a las arrugas de la piel podría ser la incapacidad de los músculos alrededor del área de la boca para moverse libremente. El aumento en el área de los poros de la piel podría ser el resultado de un aumento en la cantidad de sebo en el área de la máscara, lo que disminuye la elasticidad de la piel, lo que hace que los poros parezcan más prominentes.
Por el contrario, las mediciones de arrugas y poros de la piel disminuyeron en las áreas donde se aplicó un humectante, probablemente porque el humectante previno la pérdida de elasticidad de la piel al reduciendo la sequedad de la piel causada por el uso de mascarillas. Parece haber una relación entre la humedad y la elasticidad de la piel en el sentido de que ambas disminuyen con la edad y el hecho de que se sabe que la elasticidad de la piel influye en las arrugas y los poros de la piel.
Sin embargo, en este estudio, como en otros, fue difícil confirme que la piel se vuelve seca y menos elástica debido al uso de una mascarilla. Un estudio reciente encontró que la humedad de la piel en el área de las mejillas alrededor de la boca disminuyó después del uso de la mascarilla, pero no encontró un cambio en la humedad de la piel en el área de la barbilla; sin embargo, la duración del uso de la máscara fue más corta en ese estudio que en el presente estudio. Por lo tanto, se requieren estudios adicionales de los efectos del uso de mascarillas a largo plazo sobre la humedad y la elasticidad de la piel.
Las respuestas subjetivas a los cuestionarios fueron consistentes con los hallazgos de la evaluación objetiva de las arrugas de la piel durante el uso de la mascarilla, ya que las arrugas fueron peores en el grupo A1 que en el grupo A2. Sin embargo, no hubo diferencias significativas entre los grupos en la evaluación subjetiva del estado de los poros de la piel. Muchas mujeres de ambos grupos sintieron que los poros de su piel mejoraron durante el uso de la mascarilla. Los cambios en los poros de la piel son difíciles de detectar a simple vista y pueden existir diferencias según el tipo de piel. Por lo tanto, los estudios futuros deben incluir tamaños de muestra más grandes y sujetos con diferentes tipos de piel. Tanto los hallazgos objetivos como los subjetivos de nuestro estudio indican que el uso de una mascarilla tiene efectos mixtos sobre las características de la piel. Más de la mitad de los participantes del estudio consideró que el uso de una mascarilla afecta la piel. Por lo tanto, se necesita más investigación para determinar los cambios positivos y negativos en la piel del rostro causados por el uso de mascarillas.
CONCLUSIÓN
Se identificaron aumentos objetivos en las arrugas y los poros de la piel después del uso prolongado de una mascarilla y estos efectos mejoran con la aplicación de una crema hidratante en las áreas faciales cubiertas por la mascarilla. Más de la mitad de los participantes del estudio consideraron que el uso de mascarillas a largo plazo había afectado su piel. En vista de la pandemia de COVID-19 en curso y los niveles crecientes de contaminación del aire, es cada vez más importante comprender los cambios en las características de la piel asociados con el uso de mascarillas. Los hallazgos de este estudio pueden ayudar a la industria cosmética a responder a estos cambios.
Referencias:
Park M, Kim H, Kim S, Lee J, Kim S, Byun JW, Hwang-Bo J, Park KH. Changes in skin wrinkles and pores due to long-term mask wear. Skin Res Technol. 2021 Feb 27. doi: 10.1111/srt.13019. Epub ahead of print. PMID: 33638266.
Cambios en las arrugas y los poros de la piel debido

Asociación entre antecedentes de uso de estatinas y disminución de la mortalidad en pacientes hospitalizados con COVID-19
NATURE COMMUNICATIONS | https://doi.org/10.1038/s41467-021-21553-1
La enfermedad por coronavirus 2019 (COVID-19) puede resultar en un estado hiperinflamatorio, lo que lleva a síndrome de dificultad respiratoria aguda (SDRA), lesión miocárdica y complicaciones trombóticas, entre otras secuelas. Las estatinas, que se sabe que tienen propiedades antiinflamatorias y propiedades antitrombóticas, se han estudiado en el contexto de otras infecciones virales, pero su beneficio no se ha evaluado en COVID-19. Este es un análisis retrospectivo de pacientes admitidos con COVID-19 desde el 1 de febrero hasta el 12 de mayo de 2020 con finalización del período de estudio el 11 de junio de 2020. El uso previo de estatinas se evaluó utilizando información sobre medicamentos disponible en la historia clínica electrónica. Los autores construyeron un modelo de regresión logística multivariable para predecir la propensión a recibir estatinas, ajustando por valores sociodemográficos de referencia, características clínicas y medicación ambulatoria. El criterio de valoración principal incluyó la mortalidad intrahospitalaria dentro de los 30 días. Un total de 2626 pacientes fueron admitidos durante el período del estudio, de los cuales 951 (36,2%) estaban recibiendo estatinas. Entre 1296 pacientes (648 tratados con estatinas, 648 no tratados con estatinas) identificados con un emparejamiento de puntaje de propensión 1: 1, el uso de estatinas se asocia significativamente con menores probabilidades del criterio de valoración principal en la cohorte de propensión equiparada (OR 0,47; IC del 95%: 0,36 –0,62, p <0,001). Concluimos que el uso previo de estatinas en pacientes hospitalizados con COVID-19 se asocia con una menor mortalidad hospitalaria.
Ver artículo completo aquí:
Asociación entre antecedentes de uso de estatinas
Imitadores o inhibidores de microARN como enfoques terapéuticos antivirales contra COVID-19
https://pubmed.ncbi.nlm.nih.gov/33638807/
Los coronavirus son virus de ARN que pueden causar variedad de complicaciones en la salud humana e incluso la muerte. A la fecha, se han identificado 3 coronavirus capaces de infectar humanos: coronavirus del síndrome respira-torio agudo severo (SARS-Co-V), SARS-CoV-2 y el coronavirus del síndrome respiratorio de Oriente Medio (MERS-CoV).
El SARS-CoV-2 ha infectado aproximadamente a 100 millones de personas y causado 2 millones de muertes en todo el mundo. Mientras que algunos pacientes con COVID-19 permanecen asintomáticos o presentan síntomas leves similares a los de la gripe, otros desarrollan dificultad respiratoria grave, complicaciones cardíacas, insuficiencia renal, cho-que séptico y otras complicaciones de salud a largo plazo.
En este contexto de pandemia por COVID-19, se ha trabajado en la búsqueda de nuevas opciones terapéuticas de tratamiento antiviral. Las estrategias terapéuticas actuales para tratar a los pacientes con COVID-19 son sintomáticas, y en casos graves se administra el fármaco antiviral remdesivir.
Entre los esfuerzos actuales para combatir el COVID-19, algunos enfoques incluyen la búsqueda de inhibidores de entrada y replicación y la reutilización de medicamentos antivirales existentes. Hasta la fecha, se han registrado más de 2000 ensayos clínicos de COVID-19 en todo el mundo, que van desde enfoques de moléculas pequeñas (incluidos fármacos como lopinavir-ritonavir) hasta terapias con plasma de convalecencia y células madre
Además, diferentes organismos reguladores de todo el mundo han autorizado el uso de varias vacunas COVID-19. Sin embargo, a pesar del desarrollo de vacunas efectivas, las investigaciones continuas sobre todos los enfoques terapéuticos siguen siendo cruciales, especialmente en el contexto de las variantes emergentes del SARS-CoV-2 y las posibles cepas resistentes a las vacunas.
Una estrategia antiviral relevante para el SARS-CoV-2 podría provenir de la respuesta antiviral natural del huésped. Las células hospedadoras pueden desarrollar diferentes estrategias antivirales contra los virus de ARN, y una estrategia eficaz es la interferencia de ARN.
La interferencia de ARN incluye un grupo de moléculas conocidos como microARN (miARN / miR-), que son moléculas de ARN no codificantes, típicamente de 20-25 nucleótidos de longitud, que regulan la expresión génica, la señalización celular y el entorno de la célula huésped.
Actuando como reguladores de genes postranscripcionales, los miARN se emparejan con el 3′-UTR de secuencias de ARNm complementarias para mediar en su degradación o inhibir su traducción. También se ha informado que las interacciones miRNA-mRNA no canónicas, como las que interactúan con el 5′-UTR o las regiones codificantes de los genes diana, son funcionales.
Dado que se han identificado aproximadamente 2000 miRNAs humanos (miRBase 22), y se ha predicho que regulan más del 60% de todos los genes codificadores de proteínas humanas, los miRNAs sirven como una vía plausible para la investigación terapéutica, especialmente para la modulación de proteínas que no pueden ser dirigidas por otras moléculas pequeñas.
Hay dos enfoques generales para desarrollar terapias basadas en miARN (Figura 1). El primero se basa en el desarrollo de antagonistas o inhibidores de miARN para aumentar o rescatar la expresión de proteínas específicas que están reguladas negativamente. El segundo enfoque consiste en el uso de imitadores de miARN para regular negativamente la expresión de proteínas inducidas anormalmente. En los últimos años, varios tratamientos basados en miARN se han mostrado prometedores en ensayos clínicos.
Por ejemplo, se han desarrollado fármacos para la infección por el virus de la hepatitis C (VHC) que actúan como antagonistas de miRN-22, reduciendo los niveles de ARN viral al secuestrar el miRN-122 del genoma viral, donde el virus lo utiliza para mejorar su propagación.

Figura 1. Posibles aplicaciones terapéuticas de los miARN.
También se ha informado de que los miARN tienen un papel en el interrogatorio de las interacciones entre el huésped y el virus durante la infección viral. Ya sea a través de interacciones directas con el genoma viral o induciendo respuestas celulares antivirales en el huésped, los miARN sirven como reguladores críticos de la patogénesis viral (Figura 2).
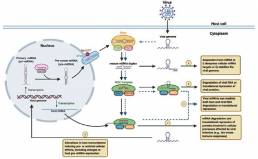
Figura 2. Posibles interacciones entre los miARN y la infección viral.
También se ha demostrado que los virus crean microambientes específicos que facilitan el ciclo de vida viral a través de alteraciones en la expresión de miARN del huésped. Esta comunicación cruzada entre los miARN del hospedador y los virus puede alterar el transcriptoma del hospedador y regular indirectamente las infecciones virales mediante la modulación de las vías celulares del hospedador, lo que da como resultado efectos pro o antivirales generales.
Por ejemplo, un estudio encontró que la expresión elevada de miR-155 en linfocitos infectados con el virus de Epstein-Barr (EBV) contribuyó a un estado celular proviral general al regular negativamente simultáneamente el factor nuclear kappa-potenciador de la cadena ligera de las células B activadas (NF-κB) la señalización, que es importante para la producción de citocinas y la supervivencia celular, y la supresión de las respuestas inmunitarias innatas a la infección viral].
De hecho, se ha demostrado que los miARN regulan la respuesta inmune innata del huésped a las infecciones virales mediante una variedad de mecanismos, que incluyen la alteración del microambiente lipídico, la promoción de vías de señalización celular que conducen a la expresión de genes antivirales inducibles por interferón (INF), o mejorando la expresión de los reguladores de la respuesta inmunitaria
Un estudio identificó miR-24, miR-124 y miR-744 como miARN antivirales de amplio espectro contra el virus de la influenza A (VIA) y el virus respiratorio sincitial (VRS). Al dirigirse a la vía de señalización de la proteína quinasa activada por mitógenos p38 (MAPK), estos miARN regulan la producción de citocinas involucradas en la respuesta inmune, así como la entrada y propagación viral, contribuyendo a un fenotipo antiviral general.
Se ha demostrado que los miARN antivirales inducidos por el VHC se dirigen al ARN viral e inhiben su replicación, mientras que otros miARN, como el miR-135a, mejoran la replicación viral a través del antagonismo de las vías antivirales celulares.
Evidentemente, como lo establecen muchos informes, las interacciones miARN-virus son extensas y complejas y poseen la capacidad de mejorar o suprimir la replicación viral.
Con respecto a la infección por VHC, se ha demostrado que los miARN antivirales inducidos por IFN se dirigen al ARN viral e inhiben su replicación, mientras que otros miARN, como el miR-135a, mejoran la replicación viral a través del antagonismo de las vías antivirales celulares.
Los miARN del huésped también pueden interactuar directamente con el genoma viral para regular las infecciones virales. Con el fin de mejorar la replicación viral, algunos virus utilizan miARN derivados del hospedador para estabilizar su genoma y prevenir la degradación.
Un ejemplo de esto incluye el proviral miR-122 mencionado anteriormente, que se une directamente al 5′-UTR del VHC y estabiliza eficazmente el ARN para promover la replicación viral. Curiosamente, el genoma del VHC también puede actuar como una «esponja» para secuestrar miR-122 lejos de sus objetivos celulares, proporcionando así otro mecanismo para mejorar su potencial infeccioso.
Otros virus, como algunos herpesvirus, también utilizan este método de secuestro de miARN para des-reprimir dianas celulares como estrategia viral para modular la célula huésped.
Por el contrario, también se ha sugerido que los miARN celulares pueden interactuar con el genoma viral para inhibir la replicación. Por ejemplo, en la infección por el virus de la inmunodeficiencia humana 1 (VIH-1), se descubrió que un grupo de miARN celulares induce la latencia viral a través de interacciones con los extremos 3 ‘del ARN viral. Además de los miARN derivados del hospedador, también se han identificado miARN codificados por virus (o miARN virales) en varios virus, incluido el VEB humano.
Al explotar la maquinaria de miARN celular del huésped, los miARN virales pueden expresarse para modular tanto los objetivos de ARN del huésped como del virus, y algunos incluso ayudan al virus a evadir la respuesta inmune del huésped. En general, al hacer que la célula huésped sea más susceptible a la infección viral o mediante interacciones directas con el virus, los miARN desempeñan un papel importante en la regulación de las infecciones virales y se pueden explorar para desarrollar nuevos antivirales.
Evidentemente, los miARN pueden regular una amplia variedad de infecciones virales, incluidas infecciones respiratorias como el VHC. Por ejemplo, un estudio realizado por Mallick et al. encontraron que las proteínas virales N y S del SARS-CoV regulaban negativamente miR-223 y miR-98, respectivamente, con el fin de modular la diferenciación de la célula huésped e inducir respuestas proinflamatorias como el aumento de la activación de quimiocinas inflamatorias. Si bien se han establecido interacciones entre los miARN y el SARS-CoV, aún no se comprende completamente la capacidad de los miARN para regular el SARSCoV-2. Dicho esto, varios grupos han realizado recientemente investigaciones computacionales sobre objetivos de miARN en el genoma del SARS-CoV-2; sin embargo, aún se requiere una mayor validación experimental para validar estas predicciones y determinar sus efectos celulares posteriores. Esta laguna en el conocimiento, junto con las opciones de tratamiento limitadas para el SARS-CoV-2, resalta la importancia de una mayor investigación sobre las interacciones de miARN y SARS-CoV-2.
En este estudio se utilizó la herramienta de búsqueda de alineación local básica de nucleótidos (BLASTn) para secuencias muy similares, para identificar posibles sitios de unión de miARN en los genomas virales de SARS-CoV-2, SARSCoV y MERS-CoV. Se identificaron miARN con un 100% de complementariedad del sitio de siembra con el genoma viral y luego se realizaron más investigaciones bibliográficas sobre sus posibles funciones en la infección por SARS-CoV-2.
Si bien los estudios sobre las interacciones entre los miARN del huésped y los genomas virales son vitales, simplemente reflejan un paso inicial en el desarrollo de terapias antivirales basadas en miARN.
Identificación de microARN con posibles funciones en la infección por SARS-CoV-2.
Considerando el potencial establecido para que los miARN influyan en las infecciones virales (ya sea con efectos pro o antivirales), se investigaron las interacciones entre los miARN humanos y el genoma del SARS CoV-2 para obtener información y dirigir el desarrollo de miARN basado en terapéutica (Figura 3A). En este enfoque, se optó por observar los miARN más comúnmente expresados en tejidos y tipos de células a menudo atacados por el virus, como una forma de identificar miARN que pueden modificar el microambiente celular del huésped para que sea más favorable para la infección viral.
Se utilizó la base de datos de nucleótidos NCBI para obtener las secuencias del genoma viral para SARS-CoV-2 (MN908947.3), SARS CoV (NC_004718.3) y MERS-CoV (NC_019843.3). Usando la base de datos mimiRNA, el centro de este estudio estuvo en los 20-30 miRNAs expresados de forma más significativa en células epiteliales pulmonares A549, corazón, hepatoma (hígado) e intestino delgado como punto de partida. A partir de los resultados obtenidos, se seleccionaron los 12 miARN principales que estaban presentes en todos los tipos de células y muy abundantes en las células A549 del epitelio pulmonar para su posterior investigación.
Se identificaron miARN adicionales a través de una revisión de la literatura de miARN que se demostró que tienen un papel en la regulación del metabolismo, la respuesta inmune y otras infecciones virales.
Las secuencias de la hebra guía para los miARN humanos (hsa) identificados para la investigación se obtuvieron a partir de miRBase. Para cada miARN, se determinó la región semilla (nucleótidos 2-8) y su correspondiente secuencia complementaria. Se utilizó BLASTn para secuencias muy similares para buscar coincidencias entre las secuencias del genoma viral (SARS-CoV-2, SARS-CoV y MERS-CoV) y las secuencias de semillas de miARN complementarias. Se predijeron los posibles sitios de unión de miARN en ubicaciones con 100% de complementariedad. Los sitios de unión predichos en el genoma del SARS-CoV se cotejaron con la base de datos ViTa utilizando la cepa TWH del SARSCoV. Para cada sitio de unión potencial, se identificó la ubicación y la región correspondiente en el genoma viral.
También se utilizó miRDB, DIANA microT-CDS y el software de predicción TargetScan para predecir los miRNA que se dirigen al 3′-UTR del receptor ACE2 en humanos (NM_021804.3) para explorar si los miRNA podrían ser buenos objetivos para el tratamiento de la infección por SARS-CoV-2.
Las búsquedas incluyeron sitios altamente y mal conservados, así como sitios de unión 6mer, 7mer, 8mer y 9mer. Los principales éxitos generados aquí proporcionan un punto de partida ideal para más análisis de expresión de miARN-ACE2 que, a su vez, pueden ayudar a dirigir el desarrollo de terapias antivirales con miARN.
(Figura 3b).
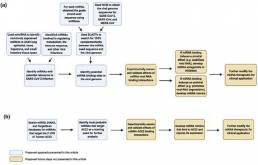
Figura 3. Descripción general del enfoque terapéutico antivírico basado en miARN propuesto contra la infección por SARS-CoV-2.
Posibles funciones y sitios de unión de microARN en los genomas del SARS-CoV-2, SARS-CoV y MERS-CoV
Entre los 39 miARN investigados, se predijo que 29 tenían sitios de unión dentro del genoma del SARS-CoV-2 en función de la complementariedad del sitio de semillas.
Se predijo un gran número de estos sitios de unión en el ORF1ab, ya que es la región más grande del genoma, abarca aproximadamente 21 kb de longitud y codifica numerosas proteínas virales. No se predijeron sitios de unión de miARN en las UTR de SARS-CoV-2 y SARS-CoV. Esto sugiere que los miARN investigados en este estudio pueden no unirse directamente al genoma viral para estabilizar o promover la degradación del ARN viral; sin embargo, los sitios de unión en las regiones codificantes pueden seguir siendo funcionales. Dado que solo se utilizó una secuencia genómica para evaluar cada virus, no se capturaron las variaciones en los genomas virales que pueden permitir sitios de unión de miARN adicionales. Además, el hecho de que los sitios de unión de miARN en los genomas virales se definieran como ubicaciones con un 100% de complementariedad del sitio de siembra es bastante restrictivo, ya que se sabe que los miARN pueden unirse a sitios de manera imperfecta.
Esto lleva a creer que es posible que no se hayan representado otros sitios de unión potenciales. Además, estos miARN celulares, con o sin sitios de unión en el genoma viral, aún pueden tener un papel en la regulación de vías inflamatorias o de señalización en el huésped, como se observa con otras infecciones virales.
En términos del genoma de MERS-CoV, se predijo que miR-92 se dirigiría a la 3′-UTR, mientras que se predijo que miR-130 y miR-199 se dirigirían a la 5′-UTR. Si bien la regulación de MERS-CoV mediada por miARN del huésped no está bien explorada, es interesante señalar que miR-199a se ha identificado previamente para regular la expresión de TMPRSS2 en el hígado, el estómago y el cuerpo uterino, ya que esta proteasa es fundamental para la entrada del SARS-CoV2, SARSCoV y MERS-CoV en las células. Por lo tanto, tras un análisis adicional y una validación experimental para determinar si estos son sitios de unión de miARN verdaderos, se pueden explorar las funciones de estos miARN en la modulación de la infección por MERS-CoV, junto con otros virus relacionados.
El número relativo y las ubicaciones de los posibles sitios de unión de miARN en el genoma también pueden proporcionar una idea de las funciones que estos miARN pueden desempeñar durante las infecciones virales.
A partir de este análisis, se encontró que miR-16 tiene el mayor número total de sitios de unión en los tres genomas virales, con 21 sitios de unión en el genoma de SAR-CoV, 15 sitios de unión en el genoma de SARS-CoV-2 y 14 de unión sitios en el genoma de MERSCoV (Figura 4). El hecho de que el elevado número de sitios de unión de miR-16 sea común entre los tres VHC podría indicar que estos virus han desarrollado mecanismos provirales que utilizan este miRNA para mejorar su propagación, como se observó previamente en el VHC. De manera similar, también se encontró que miR-29 y miR-30 tienen un gran número de sitios de unión potenciales, con diez sitios de unión predichos cada uno en el genoma del SARS-CoV-2. En términos de infección por SARS-CoV-2, se identificaron además que miR-200 y miR-24 son de particular interés, ya que se ha demostrado que están vinculados a la regulación de ACE2 y furina, respectivamente (Figura 5).
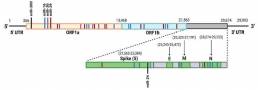
Figura 5. Representación esquemática de los sitios de unión de miARN predichos en el genoma del SARS-CoV-2.
5 microARN que regulan la expresión del receptor ACE2
Además de los miARN que interactúan directamente con el genoma viral, los miARN del huésped que se dirigen a ACE2 también pueden participar en la regulación de la infección por SARS-CoV-2. Como ACE2 es el receptor viral que facilita la entrada del SARS-CoV-2 en las células, la comprensión de qué miARN modulan su expresión puede proporcionar información para posibles tratamientos antivirales basados en miARN. En este estudio, se identificaron numerosos miARN que se dirigen a la 3′-UTR de ACE2 en humanos. Se predijó un total de seis miRNA (miR-362-5p, miR-421, miR-500a-5p, miR-500b-5p, miR-3909 y miR-4766-5p) mediante las tres herramientas de predicción de miRNA en línea. Curiosamente, miR-421 también se ha identificado previamente como un posible regulador de ACE2, lo que lo convierte en un objetivo plausible para una mayor investigación terapéutica contra el SARS-CoV-2.
Abundantes microARN cuya función normal puede ser modulada por el SARS-CoV-2
En la mayoría de los casos, los miARN regulan la expresión del gen diana uniéndose a la 3′-UTR de los ARNm; sin embargo, los genomas virales son significativamente más grandes que el ARNm normal, por lo que su regulación e interacciones con los miARN pueden ser más complicadas. Se ha demostrado que los sitios de unión de miARN en las UTR 5 ‘y 3’ y las regiones codificantes pueden ser funcionales. Si bien no se predijeron sitios de unión en el 3′-UTR del genoma del SARS-CoV-2 en este análisis, se identificaron tres miARN con sitios de unión predichos en las regiones codificantes del SARS-CoV-2 (miR-16, miR-200 y miR-24).
Funciones y vías de miR-16 que pueden verse afectadas durante la infección por SARS-CoV-2
El alto número de sitios de unión de miR-16 predichos en los tres genomas del VHC sugiere que el ARN viral puede actuar como una «esponja» para secuestrar miR-16, disminuyendo así su abundancia en las células infectadas y provocando una desrepresión de sus objetivos en el huésped. Como se determinó a partir de estudios anteriores, una función de miR-16 es inducir la apoptosis regulando a la baja el factor de supervivencia BCL2. Se ha indicado que la apoptosis es una parte importante de la respuesta inmune antiviral innata en algunas infecciones virales. Por ejemplo, en células de ratón infectadas con influenza, se encontró que la apoptosis era inducida y posteriormente las células apoptóticas eran el objetivo de los macrófagos y neutrófilos para la fagocitosis. Al regular a la baja miR-16, los virus como el SARS-CoV-2 pueden evadir este mecanismo inmune innato al suprimir la apoptosis de la célula huésped.
También se ha demostrado que la supresión de miR-16 aumenta la producción de especies de oxígeno reactivas mitocondriales (ROS) y la expresión del receptor tipo Toll 4 (TLR4).
Esto es de particular interés ya que tanto la producción de ROS como la expresión de TLR4 pueden tener efectos negativos en las células pulmonares e incluso causar daño pulmonar, algo que es pertinente en virus respiratorios como el SARS-CoV-2 y el SARS-CoV. La producción de ROS desencadena una reacción a través de la vía de señalización TLR4-TRIF que, en última instancia, aumenta la producción de citocinas en los macrófagos pulmonares, lo que provoca inflamación y daño en los pulmones. También se ha demostrado que el desequilibrio redox resultante de la infección por SARS-CoV y el aumento de la producción de ROS inducen la expresión del factor de crecimiento transformante beta 1 (TGF-β1), una citocina profibrogénica que aumenta aún más la producción de ROS, y se ha relacionado con el desarrollo de lesiones y tejido pulmonar cicatrizado, comúnmente denominado fibrosis pulmonar.
Debido a las similitudes y la alta homología entre el SARS-CoV-2 y el SARS-CoV, no es sorprendente que estos fenómenos, a saber, el aumento de la producción de citocinas y la fibrosis pulmonar, también sean evidentes en algunos casos graves de COVID-19. En conjunto, estas observaciones sugieren que la supresión viral de miR-16 puede contribuir al daño pulmonar en casos graves de COVID-19 como resultado de una mayor producción de ROS y TLR4. Por lo tanto, la regulación positiva de miR-16, quizás en forma de un imitador de miARN, puede ser una opción plausible para combatir los síntomas perjudiciales del COVID-19.
Resulta ver si estudios adicionales muestran que los sitios de unión predichos son realmente funcionales y si la esponja de miR-16 por SARS-CoV-2, SARS-CoV y MERS-CoV ocurre in vivo. Por último, es importante señalar que miR-16 está altamente conservado entre los mamíferos, lo que indica que miR-16 puede estar involucrado en un mecanismo de regulación del SARS-CoV-2 que existe en humanos y otros mamíferos, como los murciélagos, que puede ser infectado por CoV homólogos de murciélago.
Si estos HCoV de hecho han desarrollado un mecanismo que aproveche el potencial regulador del miR-16 en su anfitrión, el desarrollo de terapias que antagonicen esta interacción, como los inhibidores de miRNA para prevenir las interacciones del miR-16 con el genoma del SARS-CoV-2, es otra estrategia antiviral plausible.
Efectos potenciales de las interacciones del SARS-CoV-2 con el miR-200
Con las herramientas DIANA y TargetScan se predijo que miR-200b y miR-200c se unirían a una región altamente conservada de ACE2 3′-UTR, lo que sugiere que estos miRNA juegan un papel importante en la regulación de ACE2. Esto es particularmente importante en términos de infección por SARS-CoV-2, ya que tanto el SARS-CoV-2 como el SARSCoV utilizan el receptor ACE2 para la unión y la entrada en las células huésped.
La ACE2 también se considera un regulador negativo de la fibrosis pulmonar, ya que es responsable de la escisión de la angiotensina II (Ang II), una hormona peptídica que se ha relacionado con el desarrollo de fibrosis pulmonar mediante la activación de TGF-β. Estudios anteriores han demostrado que la regulación positiva de miR-200c-3p durante la infección por el virus de la influenza aviar A (H5N1) induce una disminución de los niveles de ACE2 y, en consecuencia, puede causar daño pulmonar. De manera similar a la infección por H5N1, se ha demostrado que el SARS-CoV-2 y el SARS-CoV inducen una disminución en la expresión de ACE2; sin embargo, no está claro si esto se debe a la unión de la proteína S al receptor o al resultado de la expresión de miR-200b / c regulada al alza. Como tal, se requiere más investigación in vitro e in vivo para determinar el perfil de expresión de miR-200b / c durante la infección por SARS-CoV y SARS-CoV-2. Además, la ECA2 se ha identificado como un importante regulador de la función cardíaca y se ha sugerido que la acumulación de Ang II puede provocar enfermedades cardíacas. Por lo tanto, investigaciones adicionales sobre la regulación de miR-200b / c de ACE2 puede proporcionar información útil sobre los factores de riesgo relacionados con el corazón y las complicaciones que ocurren en algunos pacientes infectados con SARS-CoV-2, como síndrome coronario agudo, miocarditis, arritmias y en casos graves, paro cardíaco.
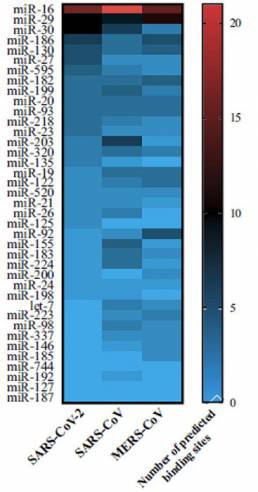
Figura 4 Número de sitios de unión de miARN predichos en los genomas de SARSCoV-2, SARS-CoV y MERS-CoV.
Funciones y vías de miR-24 que son susceptibles a la modulación por SARS-CoV-2
El sitio de unión de miR-24 predicho en la proteína S viral parece estar conservado entre los genomas de SARS-CoV-2, SARSCoV y MERS-CoV. Se ha demostrado previamente que miR-24 tiene un papel notable en la regulación de la furina, una serina proteasa que es importante para la activación proteolítica y la entrada en la célula huésped de algunos virus respiratorios, como el SARS-CoV-2, MERS-CoV, y H5N1. A menudo abundantes en varios tipos de tejidos, incluidos los pulmones, muchos virus respiratorios con envoltura utilizan la furina para escindir y modificar las glicoproteínas de superficie involucradas en la unión y fusión de la membrana, promoviendo así el potencial fusogénico del virus, que en última instancia puede provocar efectos sobre el tropismo celular y patogenicidad viral. Como existe un sitio de escisión similar a la furina (FCS) en la proteína SARS-CoV-2 S que no está presente en el SARS-CoV, hay motivos para creer que la furina puede contribuir a la patogenia e infección del SARS-CoV-2. De hecho, este FCS puede ser responsable de la alta actividad de fusión de membranas que es específica de SARS-CoV-2. Se ha demostrado que la furina activa el TGF-β1, que puede estar relacionado con el desarrollo de fibrosis pulmonar en casos graves de COVID-19. Por lo tanto, la posible regulación a la baja de miR-24 durante la infección por SARS-CoV-2 puede conducir tanto a un aumento de furina, lo que resulta en una mayor infectividad, como a un aumento de TGF-β1 que eventualmente puede conducir a daño pulmonar.
Por el contrario, un estudio encontró que el FCS y la activación por furina pueden no ser cruciales para la infección por SARS-CoV-2. Se determinó que el tratamiento de muestras infectadas con una alta concentración de proteasas similares a tripsina (HAT) de las vías respiratorias humanas restauró la capacidad fusogénica del SARS-CoV-2 sin FCS, lo que indica que el FCS y la presencia de furina pueden no ser completamente necesarios para Entrada del SARS-CoV-2 en las células huésped. En cambio, este estudio sugiere que la estructura general de la proteína S puede ser responsable de la alta actividad fusogénica del SARS-CoV-2, no la presencia del FCS; Sin embargo, sería necesaria más evidencia in vivo para apoyar esta hipótesis y descartar el posible papel.
Conclusión y direcciones futuras
En conclusión, los miARN representan objetivos nuevos y emergentes para la intervención terapéutica, incluso contra el SARS-CoV-2. Los objetivos celulares de los miARN se pueden suprimir agregando imitadores de miARN o se pueden regular al alza con el uso de anti-miR, de los cuales existen varias clases químicas. Los virus de ARN pueden interactuar y suprimir la función de los miARN endógenos, regular los miARN o incluso producir sus propios miARN en determinadas circunstancias. Se ha demostrado que contrarrestar estas interacciones evolucionadas es antiviral para otros virus como el VHC, donde los antagomir se han utilizado con éxito en ensayos clínicos. Dadas las similitudes y el tamaño del genoma del SARS-CoV-2, es razonable plantear la hipótesis de que tales estrategias también serán efectivas en el desarrollo de nuevas estrategias terapéuticas.
Tras un examen más detenido, se descubrió que varios miARN tenían sitios de unión potenciales en los genomas del SARS-CoV-2, SARSCoV y MERS-CoV. Entre ellos, se identificaron tres que se mostraron prometedores en la modulación de la infección por SARS-CoV-2, a saber, miR-16, miR-200 y miR-24. Muchos miARN humanos pueden ver una función alterada durante la infección aguda debido a un efecto de esponja del genoma del SARS-CoV-2 y la desrepresión resultante de los objetivos de ARNm. Es interesante considerar que algunas de estas interacciones pueden haber evolucionado como parte del tropismo viral como virus respiratorio y, por lo tanto, podría haberse producido una selección de cepas de virus para subvertir la señalización de miARN en las células huésped.
El trabajo actual y futuro se centra en obtener evidencia adicional para determinar si el SARS-CoV-2 realmente se basa en miARN específicos y a través de qué mecanismo. Un punto de partida sería validar los sitios de unión previstos de miARN específicos in vivo y determinar si estos sitios de unión son funcionalmente importantes para el ciclo de vida del SARS-CoV-2. Es probable que esto implique examinar características adicionales como la estructura secundaria del ARN, la abundancia de miARN y otras interacciones celulares. También resulta importante perfilar los cambios en la expresión de miARN durante la infección viral (es decir, qué miARN están regulados hacia arriba o hacia abajo), así como extender el análisis de detección de miARN para identificar miARN que se dirigen a las regiones UTR. La información sobre los efectos descendentes celulares que resultan de la expresión alterada de miARN también puede ser útil para comprender las complicaciones y síntomas asociados con la infección viral. También es importante investigar la conservación de los sitios de unión de miARN y los mecanismos reguladores entre otros mamíferos, ya que se han observado infecciones por CoV en otros mamíferos además de los humanos. Dado que algunos CoV pueden atravesar las barreras de las especies, comprender las interacciones y las regulaciones de miARN en estos genomas no humanos puede servir para mejorar nuestra comprensión de los posibles VHC emergentes como el SARS-COV-2.
En cuanto a la traducción de objetivos de miARN en terapias, es interesante observar que los miARN pueden administrarse mediante inyección o directamente en los pulmones utilizando tecnologías de aerosolización. Tanto los imitadores como los inhibidores se pueden administrar en cualquiera de estos formatos. Además, estas estrategias se pueden utilizar junto con la tecnología de ARN de interferencia pequeño (ARNip) para dirigirse directamente al genoma viral, lo que conduce a potentes terapias multicomponente basadas en ARN. Otras dependencias y susceptibilidades a la función de miARN también pueden surgir como estrategias antivirales contra el SARS-CoV-2. Por último, pueden utilizarse moduladores de moléculas pequeñas de la función de miARN para recapitular la función de miARN. Sin embargo, este último no puede ser eficaz sin que primero comprendamos las funciones de los miARN como dianas terapéuticas para la intervención y el tratamiento del SARS-CoV-2.
Referencia: Hum, C., Loiselle, J., Ahmed, N. et al. MicroRNA Mimics or Inhibitors as Antiviral Therapeutic Approaches Against COVID-19. Drugs (2021). https://doi.org/10.1007/s40265-021-01474-5
Extraído de:
https://pubmed.ncbi.nlm.nih.gov/33638807/
terapia microARN

El futuro potencial de la pandemia COVID-19 ¿Se convertirá el SARS-CoV-2 en una infección estacional recurrente?
Christopher J. L. Murray, MD¹; Peter Piot, MD²
JAMA. Published online March 3, 2021. doi:10.1001/jama.2021.2828
¹Institute for Health Metrics and Evaluation, University of Washington, Seattle
²London School of Hygiene and Tropical Medicine, London, England
Existe un optimismo creciente y la esperanza de que, en virtud de los esfuerzos de inmunización en curso, la estacionalidad (disminución de infecciones hasta agosto) y la inmunidad adquirida naturalmente, para la primavera y principios del verano de 2021 habrá en los EE. UU. una disminución sustancial en el número de muertes y hospitalizaciones relacionadas a COVID-19.
Sin embargo, este optimismo debe ser atemperado por varios factores importantes. La probabilidad de lograr la inmunidad colectiva contra el SARS-CoV-2 es baja simplemente porque no todas las personas en los EE. UU. son elegibles para vacunarse y es probable que una cuarta parte de las personas elegibles se nieguen a vacunarse. Además, las vacunas no proporcionan inmunidad total contra la infección y las vacunas disponibles actualmente son menos efectivas contra la variante B.1.351 y posiblemente otras variantes. En consecuencia, los sistemas públicos y de salud deben planificar la posibilidad de que el COVID-19 persista y se convierta en una enfermedad estacional recurrente.
La inmunidad colectiva es una construcción teórica de modelos de enfermedades infecciosas que postula que, en una población en la que cada individuo tiene la misma probabilidad de encontrarse con cualquier otro individuo, la transmisión no se mantendrá cuando la inmunidad a través de infecciones pasadas, vacunación o ambas alcance el nivel 1 (1 / R), donde R es el número de infecciones causadas por una sola infección en una población en la que todos son susceptibles.(1) La realidad difiere de esta simple noción. Primero, debido a que COVID-19 es claramente estacional, como otros coronavirus, el nivel de inmunidad colectiva será más bajo en el verano y más alto en el invierno. En segundo lugar, la inmunidad colectiva depende de cuánta interacción tengan los individuos entre sí, lo que variará según el estado o la ciudad después de que se levanten los mandatos de distanciamiento social. En tercer lugar, la mezcla no aleatoria (los individuos no tienen la misma probabilidad de interactuar entre sí) puede conducir a modificaciones del nivel de inmunidad requerido para detener la transmisión. A pesar de estos factores, algunos funcionarios de salud pública sugieren que lograr la inmunidad colectiva en invierno en presencia de nuevas variantes más contagiosas requerirá que más del 70% al 80% de las personas sean inmunes.
Tres consideraciones clave harán que lograr la inmunidad colectiva contra COVID-19 sea un desafío.
Primero, las vacunas tendrán un efecto reducido en la prevención de la infección por la variante B.1.351. Las vacunas de Moderna y de Pfizer tienen una efectividad general contra la enfermedad sintomática de aproximadamente el 95% para las variantes de tipo salvaje, mientras que las vacunas con vectores de adenovirus, como la vacuna Janssen / Johnson & Johnson, tienen una efectividad cercana al 70%. Sin embargo, la evidencia sobre la eficacia de la vacuna para prevenir la infección proviene sólo de un grupo en el ensayo AstraZeneca que mostró un 55% de protección contra la infección medida a través de hisopos nasales semanales frente al 70% de protección para la enfermedad sintomática.(2) Además, para las 3 vacunas probadas contra el Variante B.1.351, Janssen, Novavax y AstraZeneca informaron estimaciones de efectividad para la enfermedad sintomática del 57%, (3) 49%, (4) y un porcentaje estadísticamente no significativo, respectivamente. Si la variante B.1.351 se vuelve dominante, un simple cálculo sugiere que la efectividad combinada de las vacunas para prevenir la transmisión de B.1.351 en los EE. UU. podría ser solo del 50% (es decir, basado en la efectividad actual del 90% para prevenir la enfermedad sintomática × 20% reducción de la eficacia para prevenir la infección en comparación con la enfermedad sintomática y suponiendo una reducción media de la eficacia para B.1.351 del 33% [excluyendo la protección estadísticamente insignificante de la vacuna AstraZeneca]).
En segundo lugar, no recibirán la vacuna suficientes personas. Debido a que actualmente las vacunas no están autorizadas para su uso en niños, solo aproximadamente el 75% de las personas de EE. UU. son elegibles para vacunarse. Quizás lo más importante a largo plazo es que no todas las personas están dispuestas a vacunarse. Los datos recopilados diariamente a través de la iniciativa Data for Good de Facebook brindan información oportuna sobre la proporción de personas que responden sí o «sí, probablemente» a la pregunta: ¿Aceptaría la vacuna si se la ofrecieran? Estas respuestas positivas con respecto a la probabilidad de recibir la vacuna aumentaron en enero de 2021 y alcanzaron el 71%, (5) similar a la respuesta del 72% en una muestra representativa a nivel nacional.6 Incluso con una vacuna aprobada eficaz para niños, si B.1.351 o alguna otra variante se convierte en dominante, los EE. UU. pueden esperar que la inmunidad derivada de la vacuna alcance solo el 37,5% (la eficacia agregada potencial estimada del 50% para la transmisión × 75% de las personas que reciben la vacuna) en 2021 si se superan todas las dificultades de suministro y administración.
En tercer lugar, existe preocupación sobre el grado en que las infecciones previas de una variante protegen a los individuos de la reinfección con algunas variantes nuevas. Novavax informó que en un ensayo clínico de fase 2b en Sudáfrica, la tasa de incidencia de COVID-19 en el grupo de placebo, predominantemente de la variante B.1.351, fue del 3,9% tanto entre individuos con seropositividad para COVID-19 como entre aquellos que eran seronegativos para COVID-19.(7) La interpretación de Novavax de este hallazgo ha sido que la infección pasada no proporciona inmunidad contra nuevas variantes. Si eso es cierto, la inmunidad colectiva sólo se puede lograr mediante la vacunación. Pero si B.1.351 se propaga ampliamente, la inmunidad derivada de la vacuna probablemente será mucho más baja que los niveles requeridos para alcanzar la inmunidad colectiva para el invierno del hemisferio norte 2021-2022.
Varios modelos sugieren que es posible que continúen las oleadas de COVID-19 incluso sin la dominancia de B.1.351.(8) Una oleada invernal de infección con la dominancia de B.1.351 puede ocurrir en 2021-2022. Sin embargo, se puede esperar que las tasas de hospitalización y muerte sean más bajas, suponiendo que las vacunas sigan siendo más efectivas para prevenir enfermedades sintomáticas y sigan siendo efectivas para prevenir enfermedades graves y muerte. Por ejemplo, la vacuna Janssen fue más del 85% efectiva contra la enfermedades grave, incluso en Sudáfrica, sin hospitalizaciones ni muertes reportadas en el ensayo, aunque con un intervalo de confianza muy amplio para estos resultados.(3) Si la transmisión se mantuvo similar a lo que ocurrió este invierno, las hospitalizaciones y las muertes deberían ser menores en el invierno de 2021-2022. Pero la magnitud de la oleada invernal también depende del comportamiento. A través del uso de mascarillas y el distanciamiento social, se estima que solo el 19% de los residentes de EE. UU. se han infectado hasta ahora. En el próximo invierno, será problemático mantener los mandatos de distanciamiento social debido a la fatiga pública y el posible efecto duradero de la pandemia en la economía. A pesar de la protección de la vacunación, la R efectiva en ausencia de un distanciamiento social concertado y bajos niveles de uso de mascarillas podría ser mayor el próximo invierno que este invierno.
Si continúan apareciendo nuevas variantes, las oleadas invernales pueden convertirse en la norma. Esta perspectiva requiere una planificación anticipada y la consideración de una serie de estrategias para mitigar las consecuencias para las comunidades y los sistemas de salud. Se deben considerar y debatir enérgicamente cinco estrategias en los próximos meses:
1. Intensificar los esfuerzos mundiales de vacunación. Pueden aparecer nuevas variantes en cualquier lugar y una mayor transmisión aumentará la probabilidad de su aparición. La expansión intensificada de la vacunación en países de ingresos bajos y medianos junto con países de ingresos altos podría ayudar a reducir el daño del COVID-19 estacional recurrente y podría reducir la frecuencia de nuevas variantes.
2. Monitorear la epidemia y la aparición de nuevas variantes y acelerar la modificación de las vacunas para mejorar su eficacia para las variantes emergentes de alto riesgo si se demuestra que reducen significativamente la protección de la vacuna. Los EE. UU., la Unión Europea y otros países de ingresos altos deben invertir en la vigilancia global, incluida la secuenciación del genoma, para facilitar la detección temprana de variantes y rastrear tendencias a nivel local. Las estrategias para crear vacunas multivalentes y adaptar las vacunas a nuevas variantes a través de refuerzos deberán implementarse rápidamente para mantener la eficacia general de la vacuna. Si continúan surgiendo variantes, es posible que se necesite una vacunación anual, similar a la de la influenza estacional. Sin embargo, los datos de los Centros para el Control y la Prevención de Enfermedades indican que la captación de la vacuna contra la influenza estacional promedió el 50% y la eficacia estimada de la vacuna promedió el 35% de 2014 a 2019.(9) Para COVID-19, la identificación de nuevas variantes y la modificación de las vacunas para que sean eficaces para estas variantes necesita ser más eficaz.
3. Gestionar y financiar los aumentos repentinos de los hospitales en invierno. COVID-19 ha agobiado a las unidades de cuidados intensivos (UCI) en los EE. UU. este invierno. Las medidas de distanciamiento social han reducido la transmisión de COVID-19 y reducido sustancialmente la transmisión de influenza. Los hospitales de EE. UU. han evitado la doble presión sobre la disponibilidad de camas tanto de la influenza como de la infección por COVID-19. Un cambio a COVID-19 estacional recurrente hace que sea poco probable que los gobiernos adopten mandatos de distanciamiento social cada invierno, lo que podría conducir a hospitalizaciones por influenza y COVID-19. La presión sobre la disponibilidad de camas en la UCI podría requerir detener los procedimientos electivos en los meses pico, como diciembre y enero. Es posible que los hospitales necesiten desarrollar una mayor capacidad para responder a los aumentos repentinos con suficiente capacidad de camas y personal y anticipar las implicaciones financieras asociadas. Deberían considerarse mecanismos de financiación que aborden el hecho de que actualmente los ingresos hospitalarios se basan en procedimientos electivos.
4. Reducir la transmisión en los meses pico a través de la acción del empleador y la institución educativa. Aunque es poco probable que el gobierno federal o los gobiernos estatales utilicen mandatos de distanciamiento social cada invierno, los empleadores y las instituciones educativas podrían adoptar ciertas medidas. Las acciones podrían incluir establecer la vacunación obligatoria, exigir máscaras durante los meses pico de transmisión y evitar eventos de superpropagación trasladando las reuniones o clases con una asistencia superior a un cierto número a plataformas digitales. Exigir la vacunación donde esté legalmente permitido podría ayudar a aumentar las tasas de vacunación. Exigir el uso de mascarillas en los meses de invierno podría contribuir tanto a reducir la transmisión en esos entornos como a un cambio cultural hacia la aceptación normal del uso de mascarillas.
5. Modificar el comportamiento de las personas en riesgo. El aumento del riesgo de muerte en una oleada invernal puede ser lo suficientemente grande como para motivar a las personas en riesgo a cambiar su comportamiento. Las personas de mayor riesgo (p. Ej., ≥65 años o con comorbilidades) deberían considerar la modificación del comportamiento en invierno, como el uso de máscaras y evitar entornos congregados como bares, cenas interiores, conciertos y eventos deportivos, y cualquier entorno en el que haya riesgo de transmisión elevado.
No está claro si COVID-19 se convertirá en una enfermedad estacional crónica. Existe demasiada incertidumbre sobre la probabilidad y frecuencia de aparición de nuevas variantes, la reducción de la eficacia de la vacuna para cada variante, la cuestión crítica de la inmunidad entre variantes y la coherencia de un comportamiento humano seguro. Sin embargo, la perspectiva de un COVID-19 persistente y estacional es real. Si disminuye la inmunidad contra la infección por la misma variante del SARS-CoV-2 o la inmunidad derivada de la vacuna, las perspectivas aumentarían aún más. Hay mucho que aprender en los próximos meses sobre variantes, vacunas e inmunidad. El COVID-19 estacional recurrente podría requerir tanto un cambio en el sistema de salud como un profundo ajuste cultural para la vida de las personas de alto riesgo en los meses de invierno. Existe una necesidad urgente de prepararse para tal escenario alineando la vigilancia, la respuesta médica, la respuesta de salud pública y los programas socioeconómicos.
Autor para correspondencia: Christopher J. L. Murray, MD, Instituto de Métricas y Evaluación de la Salud, Universidad de Washington, 3980 15th Ave NE, Seattle, WA 98195 (cjlm@uw.edu).
Publicado en línea: 3 de marzo de 2021. doi: 10.1001 / jama.2021.2828
Divulgación de conflictos de intereses: el Dr. Piot informa haber recibido honorarios personales de la Comisión Europea como asesor, subvenciones del comité asesor del GBD, de la Fundación Bill y Melinda Gates y haber sido miembro no remunerado de la junta de CEPI durante la realización del estudio. No se informaron otras divulgaciones.
Referencias
1.Fine P, Eames K, Heymann DL. “Herd immunity”: a rough guide. Clin Infect Dis. 2011;52(7):911-916.
PubMedGoogle ScholarCrossref
2.Voysey M, Clemens SAC, Madhi SA, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2. Lancet. 2021;397(10269):99-111.
PubMedGoogle ScholarCrossref
3.Johnson & Johnson announces single-shot Janssen COVID-19 vaccine candidate met primary endpoints in interim analysis of its phase 3 ENSEMBLE trial. January 29, 2021. Accessed February 10, 2021. https://www.jnj.com/johnson-johnson-announces-single-shot-janssen-covid-19-vaccine-candidate-met-primary-endpoints-in-interim-analysis-of-its-phase-3-ensemble-trial
4. Novavax COVID-19 vaccine demonstrates 89.3% efficacy in UK phase 3 trial. News release. January 28, 2021.
https://ir.novavax.com/news-releases/news-release-details/novavax-covid-19-vaccine-demonstrates-893-efficacy-uk-phase-3
5. CMU Delphi Research Group. COVID symptom survey. Accessed February 10, 2021.
https://cmu-delphi.github.io/delphi-epidata/symptom-survey/
6. Loomba S, de Figueiredo A, Piatek SJ, et al. Measuring the impact of COVID-19 vaccine misinformation on vaccination intent in the UK and USA. Nat Hum Behav. Published online February 5, 2021. doi:
10.1038/s41562-021-01056-1PubMedGoogle Scholar
7. Efficacy data updates from Novavax’ protein-based vaccine candidate. February 2, 2021.
https://www.novavax.com/sites/default/files/2021-02/20210202-NYAS-Novavax-Final.pdf
8. Saad-Roy CM, Wagner CE, Baker RE, et al. Immune life history, vaccination, and the dynamics of SARS-CoV-2 over the next 5 years. Science. 2020;370(6518):811-818. doi:
10.1126/science.abd7343PubMedGoogle ScholarCrossref
9. CDC seasonal flu vaccine effectiveness studies. Accessed February 10, 2021.
https://www.cdc.gov/flu/vaccines-work/effectiveness-studies.htm
El futuro potencial de la pandemia COVID-19

Oxigenoterapia nasal de alto flujo para evitar la ventilación mecánica invasiva en la neumonía por SARS-CoV-2: un estudio retrospectivo
Ann Intensive Care. 2021 Feb 27;11(1):37. doi: 10.1186/s13613-021-00825-5.
La insuficiencia respiratoria aguda (IRA) por hipoxemia aguda es la principal manifestación en la enfermedad grave por coronavirus 2019 (COVID-19). En los casos más graves, los pacientes con COVID-19 son hospitalizados en una unidad de cuidados intensivos (UCI) y pueden requerir ventilación mecánica invasiva (VMI). La necesidad de VMI se asocia con una alta mortalidad.
El oxígeno nasal de alto flujo (HFNO) se utiliza cada vez más en adultos hospitalizados con IRA. Esta técnica no invasiva proporciona oxígeno humedecido y calentado con una fracción de oxígeno inspirado (FiO2) de hasta 1,0 y un caudal máximo de 60 L / min. En esta línea, se ha demostrado que el uso de HFNO reduce la necesidad de VMI en la mayoría de los pacientes hipoxémicos. Un estudio retrospectivo reciente, sugirió el mismo beneficio en pacientes con COVID-19.
Debido al hipotético riesgo de transmisión a los trabajadores de la salud al inicio de la crisis sanitaria, la opinión de los expertos recomienda restringir el uso de HFNO y limitar el flujo a 30 L / min para pacientes críticos con COVID-19. Esta recomendación llevó a los intensivistas a adoptar una estrategia de intubación temprana para limitar el uso de HFNO. Sin embargo, desde entonces se ha cuestionado el riesgo de dispersión de bioaerosoles asociado con el HFNO.
La información sobre la eficacia del uso de HFNO para prevenir la VMI no está bien establecida en la enfermedad grave por COVID-19, en donde los resultados clínicos de los pacientes tratados con HFNO en la UCI por COVID 19 son limitados. En base a esto, el objetivo del estudio realizado por Bonnet N y colaboradores en 2021 fue comparar la necesidad de VMI entre dos estrategias de oxigenación (oxigenación convencional y HFNO) en pacientes críticos con COVID 19.
Se trató de un estudio retrospectivo bicéntrico que se llevó a cabo en dos UCI de hospitales terciarios de la región de París del 11 de marzo al 3 de mayo de 2020. Se inscribieron pacientes consecutivos hospitalizados por COVID-19 e IRA que no recibieron VMI al ingreso en UCI.
Un total de 155 pacientes con COVID-19 fueron admitidos en las UCI. Entre ellos, 17 tenían criterios de no inclusión (ventilación mecánica invasiva antes del ingreso en UCI n = 7, decisión de retirar la terapia de soporte vital n = 5, ventilación mecánica no invasiva n = 5). Entre los 138 pacientes restantes, 62 (45%) fueron tratados con oxigenoterapia estándar sola y 76 (55%) con HFNO. En la gran mayoría de los casos, el HFNO se inició en las 24 h siguientes al ingreso en la UCI (66/76 pacientes [89%]).
El resultado primario fue la tasa de VMI después de la admisión a la UCI. Los resultados secundarios fueron la muerte el día 28 y el día 60, la duración de la estancia en la UCI y los días sin ventilador el día 28. Los datos del grupo de HFNO se compararon con los del grupo de oxigenoterapia estándar (SOT) mediante una puntuación de propensión ponderada.
Variable principal: En el grupo de oxigenoterapia estándar, 46/62 (74%) pacientes finalmente recibieron IMV durante la estancia en la UCI en comparación con 39/76 (51%) en el grupo HFNO (p = 0,007). Los pacientes del grupo HFNO tenían más probabilidades de tener hipertensión (49% frente a 31%, p = 0,0049) y tenían un mayor tiempo desde el inicio de los síntomas hasta el ingreso en la UCI (10 días frente a 8 días, p = 0,002). Además, los pacientes del grupo HFNO estaban más gravemente enfermos en el momento del ingreso en la UCI, como lo demuestra un mayor flujo de oxígeno antes del ingreso (9 l / min frente a 6 l / min, p = 0,003) y una frecuencia respiratoria más alta (33 por minuto frente a 30 por minuto, p = 0,018). El HFNO se asoció con una tasa significativamente más baja de IMV después de la regresión logística estándar y después de la puntuación de propensión ponderada (OR 0,37 [IC del 95%, 0,18-0,76] p = 0,007 y OR 0,31 [IC del 95%, 0,14– 0,66] p = 0,002, respectivamente).
Criterios de valoración secundarios: La mortalidad al día 28 y al día 60 no difirió significativamente entre el grupo de HFNO y el grupo de oxígeno estándar (12% frente a 24%; OR 0,52 [IC del 95%, 0,2-1,34] p = 0,17 y 16% frente al 26%; OR 0,75 [ IC del 95%, 0,32–1,8] p = 0,52, respectivamente) incluso después de la puntuación de propensión ponderada. La duración media de la estancia en la UCI no difirió después de la puntuación de propensión ponderada en el grupo de HFNO en comparación con el grupo de oxigenoterapia estándar (11,0 días frente a 12,5 días; diferencia -0,23 [IC 95%, -0,54-0,08] p = 0,14). El número de días sin ventilador en los días 28 fue mayor en el grupo de HFNO en comparación con el grupo de oxigenoterapia estándar (21 días frente a 10 días, p = 0,005).
Durante el primer período (antes del 27 de marzo), 5 pacientes recibieron HFNO. Tras la decisión de no restringir el uso de HFNO (segundo período), 71 pacientes recibieron HFNO. Entre los 172 trabajadores de la salud, 14 (8%) tenían signos clínicos de infección por SARS-CoV-2 y 6 (3%) tenían una PCR positiva para SARS-CoV-2 durante el primer período. Estas cifras fueron 4 (2%) y 0 durante el segundo período.
En base a estos resultados, se pudo concluir que el uso de HFNO en pacientes con COVID-19 con insuficiencia respiratoria aguda se asoció con un menor riesgo de ventilación mecánica invasiva.
Referencia:
Bonnet N, Martin O, Boubaya M, Levy V, Ebstein N, Karoubi P, Tandjaoui-Lambiotte Y, Van Der Meersch G, Oziel J, Soulie M, Ghalayini M, Winchenne A, Zahar JR, Ahmed P, Gaudry S, Cohen Y.
High flow nasal oxygen therapy to avoid invasive mechanical ventilation in SARS-CoV-2 pneumonia: a retrospective study.
Ann Intensive Care. 2021 Feb 27;11(1):37. doi: 10.1186/s13613-021-00825-5. PMID: 33638752; PMCID:
Oxigenoterapia nasal de alto flujo para evitar la ventilación mecánica invasiva

Efectividad de la vacuna ARNm BNT162b2 contra COVID-19 en trabajadores de la salud en Inglaterra. Estudio de cohorte prospectivo multicéntrico.
(estudio SIREN, preimpresión de The Lancet)
Antecedentes: La vacuna BNT162b2 de ARNm y las vacunas de vector adenovírico ChAdOx1 nCOV-19 se han implementado rápidamente en el Reino Unido. Hemos determinado los factores asociados con la cobertura para ambas vacunas y hemos documentado la efectividad de la vacuna de ARNm BNT162b2 en nuestro estudio de cohorte de trabajadores de la salud (TS) del personal que se somete a pruebas asintomáticas regulares.
Métodos: El estudio SIREN es un estudio de cohorte, prospectivo, entre el personal que trabaja en hospitales financiados con fondos públicos. Los factores de riesgo iniciales, el estado de vacunación (desde el 8/12 /2020-5/2/2021) y los síntomas se registraron en intervalos de 2 semanas y se documentaron todos los resultados de la reacción en cadena de la polimerasa (PCR) y anticuerpos del SARS-CoV-2. Para estimar el impacto de la vacuna BNT162b2 en todas las infecciones (asintomáticas y sintomáticas), se utilizó un modelo de fragilidad de riesgos proporcionales de efecto mixto que utiliza una distribución de Poisson para calcular las razones de riesgo para comparar el tiempo transcurrido hasta la infección en participantes vacunados y no vacunados
Hallazgos: La cobertura de la vacuna fue del 89% al 5/2/2021. Una cobertura significativamente menor se asoció con una infección previa (ORa 0,59 intervalo de confianza [IC] del 95% 0,54-0,64), mujeres (ORa 0,72, IC del 95% 0,63-0,82), menores de 35 años, pertenecientes a grupos étnicos minoritarios (especialmente negros, ORa 0,26, IC 95% 0,21-0,32), porteadores / guardias de seguridad (OR 0,61, IC 95% 0,42-0,90) o partera (ORa 0,74, IC 95% 0,57-0,97) y que viven en barrios más desfavorecidos (IMD 1 (más desfavorecido) frente a 5 (menos) (OR 0,75, IC del 95%: 0,65 a 0,87). Una dosis única de la vacuna BNT162b2 demostró una eficacia del 72% (IC del 95%: 58-86) 21 días después de la primera dosis y del 86% ( 95% CI 76-97) siete días después de dos dosis en la cohorte de anticuerpos negativos.
Conclusión: Nuestro estudio demuestra que la vacuna BNT162b2 previene eficazmente tanto la infección sintomática como la asintomática en adultos en edad laboral; esta cohorte fue vacunada cuando la variante dominante en circulación era B1.1.7 y demuestra eficacia contra esta variante.
Referencia:
Hall, Victoria Jane and Foulkes, Sarah and Saei, Ayoub and Andrews, Nick and Oguti, Blanche and Charlett, Andre and Wellington, Edgar and Stowe, Julia and Gillson, Natalie and Atti, Ana and Islam, Jasmin and Karagiannis, Ioannis and Munro, Katie and Khawam, Jameel and Group, The SIREN Study and Chand, Meera A. and Brown, Colin and Ramsay, Mary E. and Bernal, Jamie Lopez and Hopkins, Susan,
Effectiveness of BNT162b2 mRNA Vaccine Against Infection and COVID-19 Vaccine Coverage in Healthcare Workers in England, Multicentre Prospective Cohort Study (the SIREN Study).
Consultar manuscrito en preimpresión aquí:
https://ssrn.com/abstract=3790399
http://dx.doi.org/10.2139/ssrn.3790399
Efectividad de la vacuna de ARNm BNT162b2 contra COVID19 en trabajadores de la salud en Inglaterra estudio de cohorte prospectivo multicéntrico

Nuevos datos muestran que las vacunas Pfizer-BioNTech y Oxford-AstraZeneca reducen significativamente el COVID-19 grave en adultos mayores
Public Health England (PHE) ha presentado hoy una preimpresión de un estudio en condiciones reales (no experimentales) que muestra que las vacunas Pfizer y Oxford-AstraZeneca son altamente efectivas para reducir las infecciones por COVID-19 entre las personas mayores de 70 años o más. Desde enero, la protección contra el COVID sintomático, 4 semanas después de la primera dosis, osciló entre el 57 y el 61% para una dosis de Pfizer y entre el 60 y el 73% para la vacuna Oxford-AstraZeneca.
El artículo de preimpresión compara:
- La tasa de vacunación en personas sintomáticas mayores de 70 años que dan positivo por COVID-19, en comparación con aquellos que dan negativo.
- La tasa de hospitalización en casos confirmados de COVID-19 mayores de 80 años que fueron vacunados más de 14 días antes de dar positivo, en comparación con los casos no vacunados
- La tasa de muertes en casos confirmados de COVID-19 mayores de 80 años que fueron vacunados con la vacuna Pfizer más de 14 días antes de dar positivo, en comparación con los casos no vacunados.
En los pacientes de 80 años, los datos sugieren que una sola dosis de cualquiera de las vacunas es más del 80% efectiva para prevenir la hospitalización, alrededor de 3 a 4 semanas después de la inyección. También hay evidencia acerca de la vacuna Pfizer, que sugiere que conduce a una reducción del 83% en las muertes por COVID-19.
Los datos también muestran que las infecciones sintomáticas en mayores de 70 años disminuyeron de alrededor de 3 semanas después de una dosis de ambas vacunas.
El nuevo análisis se suma a la creciente evidencia de que las vacunas están funcionando y son altamente efectivas para proteger a las personas contra enfermedades graves, hospitalizaciones y muerte.
La Dra. Mary Ramsay, jefa de inmunización de PHE, dijo:
“Esto se suma a la creciente evidencia que muestra que las vacunas están funcionando para reducir las infecciones y salvar vidas.
“Si bien quedan muchos más datos por seguir, esto es alentador y estamos cada vez más seguros de que las vacunas están marcando una diferencia real.
“Es importante recordar que la protección no es completa y aún no sabemos cuánto reducirán estas vacunas el riesgo de que transmitir COVID-19 a otras personas. Incluso si ha sido vacunado, es realmente importante que el paciente continúe actuando como si tuviera el virus, practique una buena higiene de manos y se quede en casa#.
A partir de esta semana, el NHS ha comenzado a administrar segundas dosis a las personas vacunadas primero, lo que proporcionará una protección mayor y más duradera.
Estudios separados en trabajadores de la salud muestran que una dosis de la vacuna evita que las personas contraigan COVID-19 asintomático en al menos un 70%. Esto ayudará a reducir la propagación de la infección en hospitales y residencias de ancianos y, en última instancia, ofrecerá más protección a estas poblaciones vulnerables
Referencia:
Consultar artículo en preimpresión aquí:
https://khub.net/documents/135939561/430986542/Early+effectiveness+of+COVID+vaccines.pdf/ffd7161c-b255-8e88-c2dc-88979fc2cc1b?t=1614617945615
Early effectiveness of COVID-19 vaccination with BNT162b2 mRNA vaccine and ChAdOx1 adenovirus vector vaccine on symptomatic disease, hospitalisations and mortality in older adults in the UK: a test negative case control study
Jamie Lopez Bernal, Nick Andrews, Charlotte Gowe, Chris Robertson, Julia Stowe, Elise Tessier, Ruth Simmons,Simon Cottrel, Richard Roberts, Mark O’Doherty, Kevin Brown, Claire Cameron, Diane Stockton, Jim McMenamin, Mary Ramsay.
Nuevos datos muestran que las vacunas PfizerBioNTech y OxfordAstraZenec