Hedera Helix
Hedera Helix está presente en fitofármacos en forma de extracto de hojas desecadas de hiedra. Está indicado en el tratamiento sintomático del catarro agudo (inflamación) del tracto respiratorio acompañado de tos; tratamiento de los síntomas de enfermedades bronquiales inflamatorias crónicas.
El 55% de los pacientes positivos de COVID-19 presenta síntomas leves, entre los cuales se encuentra la tos seca o con esputo.
El efecto terapéutico en enfermedades de las vías aéreas del extracto seco de hojas de hiedra se debe a las propiedades secretolíticas y espasmolíticas de las saponinas del grupo glucósido que este producto contiene. Aún no se ha aclarado de manera definida el mecanismo de acción sobre el cual se basan las propiedades del extracto seco de hojas de hiedra mencionadas con anterioridad (determinadas en experimentos realizados en animales y confirmadas clínicamente).
El efecto secretolítico del extracto se debe esencialmente a la naturaleza de las saponinas de los hederaglucósidos, en tanto se considera que los efectos parasimpaticolíticos de ciertos glucósidos son la base de las propiedades espasmolíticas que se ejercen, particularmente, en los bronquios inflamados. (1)
Dosis y administración propuestas para COVID-19
Si no se prescribe lo contrario, administrar a los lactantes y niños pequeños 2,5 ml 3 veces por día, a los niños en edad escolar y a los adolescentes 5 ml 3 veces por día, y a los adultos 5 – 7,5 ml de la solución 3 veces por día.
Precauciones y advertencias
• Contiene Sorbato de potasio. Por contener sales de potasio puede ser perjudicial para aque-llos pacientes con insuficiencia renal o con indicación de dieta baja en potasio.
• Contiene Sorbitol. Los pacientes con intolerancia hereditaria a la fructosa no deben tomar es-te medicamento.
• Embarazo y lactancia: por lo general, los medicamentos sólo deben tomarse durante el emba-razo y la lactancia después de consultar con un médico.
Eventos adversos
En casos raros, Hedera Helix puede tener un efecto laxante debido al contenido de sorbitol en el producto.
En casos muy raros se han notificado reacciones de hipersensibilidad alérgica. Pacientes sensibles a molestias gastrointestinales ocasionalmente pueden presentar náuseas, vómitos o diarrea.
Estudios clínicos (2-14)
En un estudio publicado en 2014, Zeil S. et. al. estudiaron el efecto bronquiolítico de la α-hederina, el cual se demostró mediante mediciones de tensión isométrica utilizando tiras de músculo liso traqueal bovino. La α-hederina aumentó la relajación inducida por isoprenalina indirectamente, probablemente al inhibir la desensibilización heteróloga inducida por altas concentraciones de ligandos muscarínicos como la metacolina. La alfa-hederina (1μM) inhibió la internalización de las proteínas de fusión del receptor β2-adrenérgico-GFP, mientras que ni el hederacósido C ni la hederagenina (1 μM cada uno) influyeron en la regulación del receptor. La alfahederina inhibió la internalización de los receptores β2-adrenérgicos (ß2AR) en condiciones estimulantes. Las células alveolares tipo II pretratadas con α-hederina y las células de músculo liso de las vías respiratorias humanas revelaron un aumento de la unión de ß2AR y un nivel elevado de cAMP intracelular. El extracto de hojas etanólicas (50 mg / kg de peso corporal) administrado por vía oral en el modelo de aire comprimido en cobayas inhibió dependientemente de la dosis la broncoconstricción inducida por la inhalación de ovoalbúmina (57% de inhibición) y el factor de activación de plaquetas (43% de inhibición ). El efecto de la α-hederina (0.02 mg/kg) sobre la patología del tejido pulmonar y los niveles de los mediadores inflamatorios; el ARNm de IL-2, el ARNm de IL-17 y los MicroARN (miARN)-133a se evaluaron en un modelo de asma sensibilizado con ovoalbúmina (OVA) de rata. Los niveles de ARNm de IL-2 e IL-17 fueron mayores en el grupo sensibilizado a OVA que en los controles, mientras que el nivel de expresión del gen miRNA-133a fue menor. El pretratamiento con α-hederina disminuyó los niveles de ARNm de IL-17 y aumentó la expresión del gen miRNA-133a en comparación con los animales sensibilizados con OVA. Todos los cambios patológicos en los grupos pretratados fueron más bajos que el grupo sensibilizado con OVA. Los resultados mostraron un efecto beneficioso de la α-hederina en ratas sensibilizadas con OVA, lo que sugiere que la α-hederina afectó las vías de secreción de IL-2 e IL-17 y alteró la expresión de miRNA-133a.
En un estudio publicado en 2015, Greunke et al. identificaron si compuestos adicionales cercanos a la α-hederina también median un aumento de la respuesta adrenérgica ß2, los autores examinaron los ingredientes de un extracto seco de hojas de hiedra (EA 575) ácido protocatecuico, ácido neoclorogénico, ácido clorogénico, ácido criptoclorogénico, rutina, kaempferol-3- O-rutinósido, ácido 3,4-, 3,5- y 4,5-dicaffeoilquinico, hederacósido B y ß-hederina. Dentro de todas las sustancias probadas, solo la ß-hederina inhibió la internalización de ß2AR marcado con GFP en transfectados de forma estable Células HEK293. Utilizando espectroscopía de correlación de fluorescencia ß-hederina (1 µM, 24 h) HASM pretratado, las células mostraron un aumento estadísticamente significativo en la unión de ß2AR de 33.0 ± 8.9% a 44.1 ± 11.5%. El aumento de la unión se encontró selectivamente para el complejo receptor-ligando con movilidad lateral no restringida, mientras que la unión de ß2AR con movilidad lateral impedida no se vio afectada. Comparado con células control, se observó un aumento estadísticamente significativo de 17.5 ± 6.4% (n = 4, p <0.05) y 24.2 ± 5.8% (n = 4, p <0,001) en la formación de AMPc para células HASM pretratadas con ß-hederina después de la estimulación con 10 µM de terbutalina y estimulación simultánea con 10 muM de terbutalina y 10 µM de forskolina.respectivamente. Dentro de este estudio sistemático centrado en la influencia de los ingredientes de las hojas de una hiedra extracto seco en células HASM fue posible identificar ß-hederina como componente adicional presumiblemente responsable de los efectos ß2-miméticos.
El efecto de la administración oral de Hedera helix (100 mg/kg, una vez al día durante una semana) sobre la histopatología pulmonar se evaluó en un modelo murino de asma crónica en ratones sensibilizados con ovoalbúmina. La histopatología de las vías aéreas se evaluó mediante microscopía de luz y electrónica. La administración de Hedera helix redujo el recuento de células caliciformes y el grosor de la membrana basal en las vías respiratorias asmáticas. Se realizó un estudio cruzado aleatorio, doble ciego, controlado con placebo, en 30 niños que padecían asma alérgica persistente leve parcial o no controlada. Los pacientes recibieron extracto seco de hojas de hiedra durante cuatro semanas además de su tratamiento con corticosteroides inhalados o placebo, seguido de una fase de lavado antes de cambiar al otro tratamiento. Hubo una mejora significativa de MEF (75-25), MEF25 y VC después del tratamiento con extracto seco de hojas de hiedra (cambio de MEF (75-25) en la media 0.115 l/s, p = 0.044; cambio de MEF25 en la media 0.086 l/s, p = 0.041; cambio de VC en la media 0.052 l, p = 0.044), pero no después del tratamiento con placebo.
Se estudió la eficacia de los extractos de hojas secas de hiedra (Hedera helix) en el tratamiento de la obstrucción crónica de las vías respiratorias en niños con asma bronquial. Las gotas que contenían extracto de hoja de hiedra fueron significativamente superiores al placebo en la reducción de la resistencia de las vías respiratorias (P = 0.04). El jarabe y los supositorios mostraron no inferioridad en comparación con las gotas. Los ensayos indicaron que las preparaciones de extracto de hoja de hiedra mejoraron las funciones respiratorias de los niños con asma bronquial crónica. 9657 pacientes (5181 niños) con bronquitis (enfermedad inflamatoria bronquial aguda o crónica) fueron tratados con un jarabe que contenía extracto seco de hoja de hiedra. Después de 7 días de terapia, el 95% de los pacientes mostraron mejoría o curación de sus síntomas. La seguridad de la terapia fue muy buena con una incidencia general de eventos adversos del 2.1% (principalmente trastornos gastrointestinales 1.5%). La aplicación adicional de antibióticos no tuvo un beneficio respectivo a la eficacia del jarabe de extracto seco de hoja de hiedra sola.
Dos formulaciones de un extracto de hierbas de hiedra, jarabe y pastillas para la tos, se estudiaron para determinar su eficacia y seguridad en el tratamiento pediátrico de la tos y la bronquitis en dos estudios abiertos independientes, no intervencionistas, con idéntico diseño. Doscientos sesenta y ocho niños de 0 a 12 años fueron tratados con una de las dos preparaciones por hasta 14 días. Los efectos sobre los síntomas relacionados con la tos se abordaron en una escala de calificación verbal. Al final del estudio, se encontró que los principales síntomas de rinitis, tos y mucosidad viscosa solo se expresaban levemente o estaban ausentes en 93, 94.2 y 97.7% de los casos, respectivamente. El efecto global se calificó como (bueno) o (muy bueno) en el 96,5% de los casos.
Los cambios en los síntomas de la tos después del tratamiento con una preparación herbal combinada que contiene extracto seco de hoja de hiedra como ingrediente activo principal, decocción de tomillo y anís, y mucílago de raíz de malvavisco y su tolerabilidad se investigaron en un ensayo clínico abierto. El estudio se realizó en 62 pacientes. Los resultados mostraron que, en la visita final, todos los puntajes de los síntomas mostraron una mejora en comparación con el valor inicial. Los médicos y los pacientes evaluaron la eficacia como buena o muy buena en el 86% y el 90% de los casos, respectivamente.
Se realizó un estudio aleatorio doble ciego para evaluar la eficacia y la tolerabilidad del extracto blando de hojas de hiedra con otro extracto de hojas de hiedra. El estudio se realizó en 590 pacientes con bronquitis aguda. Fueron tratados durante 7 días (± 1). El puntaje de gravedad de la bronquitis (BSS, Bronchitis Severity Score) disminuyó gradualmente y de manera similar desde el día 1 hasta el día 7 en ambos grupos de tratamiento. A partir de valores de 6.2-6.3 ± 1.2, el BSS disminuyó en aproximadamente 4.7-4.9 puntos hasta el día 7, de modo que los pacientes abandonaron el estudio con un BSS medio de 1.4-1.6. Las subescalas BSS tos, esputo, rhales / rhonchi, dolor en el pecho durante la tos y disnea mejoraron en un grado similar en ambos grupos de tratamiento.
La eficacia y la tolerabilidad de una combinación fija de extracto fluido de hojas de tomillo e hiedra (5,4 ml tres veces al día, tratamiento de 11 días) se evaluaron mediante un estudio doble ciego, controlado con placebo, multicéntrico, realizado en 361 pacientes ambulatorios que padecían bronquitis aguda con producción productiva. tos. La eficacia del tratamiento se evaluó mediante el recuento diario de ataques de tos del paciente durante el día (contador manual), la evaluación de los síntomas relacionados con la bronquitis aguda y la evaluación del investigador de los síntomas más importantes de la bronquitis aguda utilizando el BSS. La reducción media de los ataques de tos en los días 7 a 9 en relación con el valor inicial fue del 68,7% con la combinación de tomillo-hiedra en comparación con el 47,6% con placebo (p <0,0001). En el grupo de combinación de tomillo-hiedra, se alcanzó una reducción del 50% en los ataques de tos desde el inicio 2 días antes en comparación con el grupo de placebo. El tratamiento fue bien tolerado sin diferencias en la frecuencia o gravedad de los eventos adversos entre la combinación de tomillo-hiedra y los grupos de placebo. No se informaron eventos adversos graves o graves. En consecuencia, los autores concluyeron que el tratamiento oral de la bronquitis aguda con la combinación de tomillo-hiedra durante aproximadamente 11 días fue superior al placebo en términos de eficacia. El tratamiento fue seguro y bien tolerado.
En una revisión sistemática publicada en 2010 por Felix Holzinger et. al. se buscaron ensayos controlados aleatorios (ECA), ensayos clínicos controlados no aleatorios y estudios observacionales que evalúen la eficacia de las preparaciones de hiedra para las infecciones agudas del tracto respiratorio superior (URTI, Upper Respiratory Tract Infections) agudas. Tres estudios evaluaron una combinación de hiedra y tomillo, 7 estudios investigaron monopreparaciones de hiedra. Todos los estudios concluyen que los extractos de hiedra son efectivos para reducir los síntomas de URTI.
Inserto del producto ABRILAR® EA 575® Jarabe para la Tos
Referencias bibliográficas
1. European Medicines Agency (EMA). Assessment report on Hedera helix L., folium 21 November 2017. EMA/HMPC/325715/2017. Committee on Herbal Medicinal Products (HMPC). Disponible en:
https://www.ema.europa.eu/en/documents/herbal-report/final-assessment-report-hedera-helix-l-folium-revision-2_en.pdf
2. Ali Esmail Al-Snafi. Pharmacological and therapeutic activities of Hedera helix-A review. Mayo 2018. University of Thi-Qar – College of Medicine. Disponible en:
https://www.researchgate.net/publication/325809620_Pharmacological_and_therapeutic_activities_of_Hedera_helix-A_review
3. Sieben, A.; Prenner, L.;Sorkalla, T.; Wolf, A.; Jakobs, D.; Runkel, F.; Häber-lein, H. „a-Hederin but Not Hederacosid C and Hederagenin from Hedera Helix Affects the Binding Behaviour Dynamics and Regulation of β2-Adrenergic Recep-tors “ Sieben et al_2009_alpha-Hederin Biochemistry-48-Nr15-S.3477-82
4. Bolbot Yu, Prokhorov E, Mokia S, Yurtseva A. Comparing the efficacy and safety of high-concentrate (5-7,5:1) ivy leaves extract and Acetylcysteine for treatment of children with acute bronchitis. Drugs of Ukraine. November 2004
5. European Scientific Cooperative on Phytotherapy. Hederae helicis folium. ESCOP monographs. The scientific foundation for herbal medicinal products. 2nd edition. Completely revised and expanded. Thieme 2003: 241-247
6. Hecker M. Wirksamkeit und Verträglichkeit von Efeuextrakt bei Patienten mit Atemwegserkrankungen. NaturaMed 1999; 14 (2): 28-33
7. Hecker M, Runkel F, Völp A. Behandlung chronischer Bronchitis mit einem Spezialextrakt aus Efeublättern – multizentrische Anwendungsbeobachtung mit 1350 Patienten. Forsch Komplementärmed u Klassische Naturheilkunde 2002;
8. Lässig W, Generlich H, Heydolph F, Paditz E. Wirksamkeit und Verträglichkeit efeuhaltiger Hustenmittel. TW Pädiatrie 1996; 9: 489-491
9. Landgrebe H, Matusch R, Runkel F, Hecker M. Wirkung und Anwendung einer alten Heilpflanze. PZ 1999; 144: 11-15
10. Maidannik V, Duka E, Kachalova O, Efanova A, Svoykina S, Sosnovskaja T. Effi-cacy of Prospan application in children’s diseases of respiratory tract. Pediatrics, To-cology and Gynecology 2003; 4: 1-7
11. Runkel F, Prenner L, Häberlein H. In-vitro-Studien. Ein Beitrag zum Wirkmechanismus von Efeu. PZ 2005; 4: 19-25
12. Häberlein et al. “Ivy leaves dry extract; Mechanism of action deciphered further.” Naturamed (2011)
13. Felix Holzinger, Jean-François Chenot. Systematic Review of Clinical Trials As-sessing the Effectiveness of Ivy Leaf (Hedera Helix) for Acute Upper Respiratory Tract Infections. 16 de mayo del 2010. Volume 2011. Article ID 382789.
https://doi.org/10.1155/2011/382789
14. Greunke C, Hage-Hülsmann A, Sorkalla T, Keksel N, Häberlein F, Häberlein H. A systematic study on the influence of the main ingredients of an ivy leaves dry extract on the β2-adrenergic responsiveness of human airway smooth muscle cells. Abril 2015. Pulm Pharmacol Ther.31:92-8. doi: 10.1016/j.pupt.2014.09.002.

Inserto Abrilar
Conexion Abrilar
Universidad de Oxford comienza estudios clínicos sobre vacuna para SARS-CoV-2
La Universidad de Oxford posee una vacuna candidata para luchar contra el virus SARS-CoV-2, y ya se encuentran probando su comportamiento en un estudio clínico fase 1, en voluntarios sanos. El gobierno de Reino Unido ha brindado £20 millones para colaborar con el programa de desarrollo de esta vacuna, ChAdOx1 nCoV-19; y brindará £22.5 millones para el estudio fase 2 de la misma.
Este proyecto, asesorado por Sarah Gilbert y su grupo de colaboradores, comenzó el desarrollo de la vacuna el 10 de Enero de 2020, con un avance sorprendentemente rápido. La vacuna candidata se basa en el vector de adenovirus de chimpancé sin capacidad de replicarse, llamado ChAdOx1. La vacuna, ChAdOx1 nCoV-19 ha sido diseñada para codificar la proteína viral spike, y desencadenar la producción de la proteína viral que luego preparará al sistema inmune para reconocer la infección por SARS-CoV-2.
Vacunas realizadas con el virus ChAdOx1 han sido dadas a más de 320 personas hasta la fecha, y han mostrado ser seguras y bien toleradas; aunque han tenido la presencia de eventos adversos temporales como fiebre, dolor de cabeza y dolor en el brazo.
El estudio clínico multicéntrico contará con 1.100 participantes de 18-55 años que no hayan tenido infección con SARS-CoV-2, los cuales serán randomizados ciegamente para el grupo tratamiento (que recibirá la vacuna candidata para Covid-19) o el grupo control (que recibirá la vacuna de meningitis MenACWY, globalmente disponible). Por otra parte, al comienzo del ensayo se separará un grupo de 10 voluntarios que recibirán en total 2 dosis de la vacuna candidata, con 4 semanas de separación entre ambas dosis. Luego de la administración de la vacuna, los pacientes serán seguidos por 3 semanas en total.
La obtención de los resultados del estudio dependerá de la velocidad de reclutamiento. Varias vacunas no son prometedoras incluso antes de ser evaluadas en estudios clínicos, y varias de ellas que son estudiadas clínicamente no demuestran eficacia. Si este fuera el caso de esta vacuna, los responsables del proyecto revisarán cuidadosamente los resultados y examinarán alternativas como utilizar distintas dosis, pero potencialmente podrían cancelar el proyecto.
Bibliografía:
– Universidad de Oxford, Reino Unido.
http://www.ox.ac.uk/news/2020-04-23-oxford-covid-19-vaccine-begins-human-trial-stage#
– Gen: Genetic Engineering and Biotechnology News.
https://www.genengnews.com/news/uk-starts-oxford-coronavirus-vaccine-trial-as-germany-green-lights-clinical-trial-for-biontech-and-pfizer/
Conexion Megalabs - Universidad de Oxford comienza estudios clínicos sobre vacuna para SARS-CoV-2
Alemania autoriza estudio clínico para evaluar vacuna contra SARS-CoV-2
El Instituto Federal de Vacunas y Biomedicina de Alemania, Paul-Ehrlich-Institut, ha comunicado la autorización del primer estudio clínico de una vacuna de Covid-19 (EudraCT: 2020-001038-36). BioNTech es la compañía que ha desarrollado esta vacuna (BNT162), denominada vacuna ARN; y Pfizer trabajará en el escalado industrial de la misma.
El estudio clínico reclutará 200 voluntarios sanos de 18-55 años y constará de dos partes. En la primera, los participantes serán vacunados con una o más variantes de la vacuna. Los candidatos de vacunas poseen ARN viral con ligeras variaciones, como las longitudes de los tipos de ARN presentes en la vacuna, y el ARN específico de la proteína viral espiga (spike) con variaciones. Se evaluará la tolerabilidad, la habilidad de generar una respuesta inmune a SARS-CoV-2 y el efecto de una segunda vacunación.
Luego de un período de observación tendrá lugar la segunda parte del estudio, donde otros voluntarios con mayor riesgo de infección serán reclutados y vacunados. La segunda parte del estudio será autorizada posteriormente.
El perfil de riesgo-beneficio ha sido analizado de forma cuidadosa antes de aprobar este estudio, gracias a la exhaustiva información provista por BioNTech. Este estudio se aprobó el 20 de Abril y se espera su comienzo próximamente.
Bibliografía:
– Federal Institute for vaccines and biomedicines. Germany Government.
https://www.pei.de/EN/newsroom/press-releases/year/2020/08-first-clinical-trial-sars-cov-2-germany.html
– EU Clinical Trial Register:
https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001038-36/DE#P
Conexion Megalabs -Alemania autoriza estudio clínico para evaluar vacuna contra SARS-CoV-2
Enoxaparina
La Enoxaparina sódica, heparina de bajo peso molecular (HBPM) para administración por vía subcutánea (SC), intravenosa (IV) o vía arterial (hemodiálisis), fue aprobada para su comercialización por la Agencia Española de Medicamentos (AEMPs) en 1989 y por la FDA en el año 1993.(1,2) Está indicada para la prevención de la formación de coágulos durante la hemodiálisis; tratamiento de la trombosis venosa profunda establecida, con o sin embolia pulmonar; profilaxis de la trombosis venosa en pacientes quirúrgicos y no quirúrgicos inmovilizados, con riesgo moderado o elevado; tratamiento de angina inestable e infarto de miocardio sin onda Q, con administración concurrente de ácido acetilsalicílico (AAS); tratamiento de infarto agudo de miocardio con elevación del segmento ST (IAMEST), incluyendo pacientes que van a ser tratados farmacológicamente o sometidos a Intervención Coronaria Percutánea (ICP). (1)
Estudios recientes han descrito que la enfermedad COVID-19 se ve complicada por coagulopatía. La coagulación intravascular diseminada (DIC, de sus siglas en inglés Disseminated intravascular coagulation) parece existir en la mayoría de los pacientes que han fallecido por esta enfermedad. Muchos pacientes con COVID-19 cumplen con los criterios de sepsis-3, Third International Consensus Definition for Sepsis. El reposo prolongado por hospitalización y los tratamientos hormonales que son susceptibles a ser administrados en estos pacientes aumentan el riesgo de tromboembolismo venosos (VTE, venous thromboembolism). Es por estas razones que consensos de expertos en China comenzaron a recomendar el tratamiento con anticoagulantes a pacientes con COVID-19 severo. (3)
La disfunción de las células endoteliales inducida por una infección como la del COVID-19 resulta en un exceso de generación de trombina y una parada de la fibrinolisis, lo cual induce al paciente en un estado de hipercoagulación. Además, la hipoxia presente en pacientes COVID-19 severos puede estimular la trombosis, no solo a través del aumento de la viscosidad sanguínea, sino también a través de la transcripción del factor de transcripción inducible por hipoxia. Las disecciones pulmonares de pacientes COVID-19 han mostrado oclusión y formación de microtrombos en los vasos pequeños del pulmón. (3)
En un estudio realizado por Tang et. al. y publicado en marzo del 2020, se vio que el dímero D, el tiempo de protrombina y la edad están positivamente correlacionadas con la mortalidad por COVID 19 en un análisis multivariante. La mortalidad a los 28 días de los usuarios de heparina fue menor que los no usuarios en pacientes con puntaje SIC (de sus siglas en inglés, Sepsis-induced coagulopathy) ≥4 (40.0% vs 64.2%, p=0.029) y con niveles de dímero D más de seis veces superiores al límite normal (32.8% vs 52.4%, p=0.017). Se concluyó por lo tanto que la terapia anticoagulante (principalmente con HBPM) parece estar asociada con un mejor pronóstico en pacientes graves con COVID-19 que cumplen con criterios SIC o con dímero D notablemente elevados. (3)
En un estudio publicado por Tang et. al. en abril del 2020, se mostro también que los pacientes no-sobrevivientes a COVID-19 mostraban no solo un aumento del dímero D, sino un aumento de los niveles del producto de degradación de la fibrina (FDP, Fibrin degradation product), así como un tiempo de protrombina (PT, Protrombin time) y tiempo de tromboplastina parcial activada (APTT, Activated partial thromboplastin time) más largos en comparación con los sobrevivientes a COVID-19, o con los tiempos presentes en los pacientes al momento de la admisión hospitalaria. El 71.4% de los no-sobrevivientes fueron compatibles con el criterio de coagulación intravascular diseminada durante su hospitalización. Mientras tanto, 0.6% de los pacientes que sobrevivieron fueron compatibles con este criterio. Se concluyó por lo tanto que resultados anormales en la coagulación (especialmente dímero D y FDP elevados), se observan frecuentemente en pacientes con neumonía por coronavirus (NCP, novel coronavirus psneumonia). (4)
Con respecto a la elección del anticoagulante, las heparinas se unen fuertemente a las proteínas de pico COVID-19 (Coronavirus spike proteins, S) y regulan negativamente la IL-6, amortiguando directamente la activación inmune. Los anticoagulantes orales directos (DOAC de sus siglas en inglés Direct Oral Anticoagulants) no parecen tener estas propiedades antiinflamatorias. (5,6)
La Enoxaparina está siendo incluida en algoritmos de pacientes hospitalizados con COVID19, según algoritmo del Sistema de Salud Monte Sinaí en Nueva York: (7)
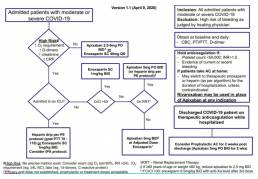
La definición de alto riesgo de progresión a UCI es la siguiente:
– No hay pruebas suficientes para definir con precisión «alto riesgo» o proporcionar valores de corte específicos para factores individuales
– Los médicos deben considerar una combinación de resultados del examen (por ejemplo, respiración dificultosa, RR> 24, disminución O2 sat <90%), mayor requerimiento de O2 (por ejemplo: ≥4L NC) y biomarcadores de laboratorio (por ejemplo: PCR elevada, elevada creatinina, dímero-d ascendente> 1.0).
El Rivaroxaban se puede usar en lugar de Apixaban en este algoritmo
Dosis y administración propuestas para COVID-19(7)
De acuerdo al algoritmo de tratamiento citado anteriormente:
• Para los pacientes no admitidos en la unidad de cuidados intensivos, la dosis es de 1mg/kg de enoxaparina subcutánea dos veces por día, si el clearence de creatinina es mayor a 50.
• Para los pacientes no admitidos en UCI, la dosis de enoxaparina subcutáena es de 1mg/kg dos veces por día.
Precauciones y advertencias (1)
• La enoxaparina sódica puede producir sangrado en cualquier lugar del cuerpo.
• No se deben intercambiar heparinas de bajo peso molecular. Éstas no son necesariamente equivalentes. Las heparinas de bajo peso molecular difieren entre sí a nivel farmacocinético y de su actividad biológica asociada.
• Usar con precaución en pacientes con: alteraciones en la coagulación, insuficiencia hepática, historia de úlcera péptica, hipertensión arterial grave y sin controlar, alteración en la retina del ojo, uso concomitante de medicación que tenga efecto sobre la homeostasis.
• En pacientes sometidos a anestesia espinal/peridural o a punción lumbar, la administración de enoxaparina sódica con fines profilácticos se ha asociado raramente a la aparición de hematomas neuroaxiales, con el resultado final de parálisis prolongada o permanente. Este riesgo se incrementa por el uso de enoxaparina sódica a dosis elevadas, por el uso de catéteres espidurales o espinales postoperatorios, la administración concomitante de medicamentos con efecto sobre la coagulación como AINEs, antiagregantes plaquetarios o anticoagulantes, y por las punciones neuroaxiales traumáticas o repetidas o en pacientes con un historial de cirugía espinal o deformidad espinal.
• En pacientes con 80 años o más, tratados con dosis terapéuticas, puede aumentar el riesgo de hemorragias. Esto no se ha observado cuando se trata al paciente con dosis de profilaxis. Se recomienda una monitorización clínica cuidadosa para pacientes de edad avanzada.
• Pacientes con insuficiencia renal tiene mayor riesgo de sufrir hemorragias con la administración de enoxaparina sódica, ya que quedan más expuestos a esta sustancia.
• Pacientes de bajo peso (mujeres de menos de 45 kg y hombres de menos de 57 kg) tienen mayor riesgo de sufrir hemorragias con la administración de enoxaparina sódica, con las dosis administradas en profilaxis. Pacientes obesos (IMC > 30 kg/m2) tienen mayor riesgo de sufrir tromboembolismo. No se ha determinado completamente la seguridad y eficacia de las dosis profilácticas en pacientes obsesos y no hay consenso para el ajuste de dosis. Monitorear de cerca a estos pacientes para detectar signos y síntomas de tromboembolismo.
• Con las heparinas de bajo peso molecular también existe el riesgo de trombocitopenia inducida por la heparina y mediada por anticuerpos. Estas trombocitopenias aparecen habitualmente entre el día 5 y 21 después del comienzo del tratamiento con enoxaparina. Por lo tanto, es recomendable efectuar un recuento de plaquetas antes del comienzo de la terapia y después regularmente a lo largo del tratamiento con enoxaparina. Ante cualquier descenso significativo (30 a 50 % del valor inicial) del recuento de plaquetas el tratamiento con enoxaparina debe interrumpirse inmediatamente e instaurarse otra terapia de sustitución.
• Para minimizar el riesgo de hemorragia después de la instrumentación vascular durante el tratamiento de la angina inestable e infarto de miocardio sin onda Q y en infarto agudo miocardio con elevación del segmento ST, se han de respetar de forma exacta los intervalos posológicos de tiempo recomendados para este medicamento. Es importante conseguir la hemostasis en el lugar de la punción tras llevar a cabo la ICP.
• Tener especial cuidado en pacientes con válvulas cardíacas artificiales. Se han notificado casos aislados de trombosis en prótesis valvulares cardíacas en pacientes en los que se administró enoxaparina sódica como profilaxis. Ciertos factores que incluyen patologías de base y la falta de datos clínicos limitan la evaluación de estos casos. Algunos de estos casos se dieron en embarazadas en las que las trombosis condujeron a un desenlace fatal tanto para la madre como para el feto. Las mujeres embarazadas con prótesis valvulares cardiacas pueden tener un mayor riesgo de tromboembolismo. El uso de enoxaparina sódica como tromboprofilaxis en mujeres embarazadas con prótesis valvulares cardíacas no ha sido suficientemente estudiado.
• En pacientes tratados para prevenir tromboembolismo venoso, los análisis de sangre arrojan normalmente resultados normales. A dosis mayores pueden aparecer incrementos en el tiempo de tromboplastina parcial activada (PTT) y en el tiempo de coagulación activado (ACT). Los aumentos de PTT y ACT no se correlacionan de forma lineal con el incremento de actividad antitrombótica de enoxaparina sódica y por tanto no son adecuados ni fiables para la monitorización de la actividad de enoxaparina sódica.
• El producto no debe ser administrado por vía intramuscular.
• El producto no debe ser administrado junto con otros productos.
Eventos adversos(1)
• Hemorragias: Factores como lesiones en órganos y asociaciones con medicamentos que actúan en el mecanismo de la coagulación, pueden favorecer las hemorragias.
• Trombocitopenia y trombosis
• Otros efectos adversos:
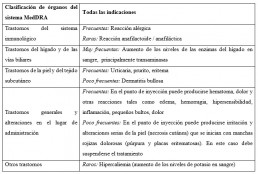
• Experiencia post comercialización
– Sistema inmunológico: reacción anafilactoide/anafiláctica, incluyendo shock.
– Trastornos del sistema nervioso: dolor de cabeza.
– Trastornos vasculares: hematomas en la médula espinal o epidural, cuando se ha aplicado una anestesia de tipo intradural/epidural o de tipo punción intradural, cuando el paciente está recibiendo al mismo tiempo enoxaparina sódica. Estas reacciones resultaron en diversos grados de daños neurológicos a largo plazo o en parálisis permanente.
– Trastornos de la sangre y del tejido linfático: anemia hemorrágica, eosinofilia, trombocitopenia inmunoalérgica con trombosis; en algunos de ellos la trombosis se complicó con infartos de órganos o isquemia de las extremidades.
– Trastornos de la piel y del tejido subcutáneo: vasculitis cutánea, necrosis cutánea en el punto de inyección. Nódulos en el lugar de inyección (que no contienen enoxaparina), alopecia.
– Trastornos hepatobiliares: lesión hepática hepatocelular, lesión hepática colestásica.
– Trastornos musculoesqueléticos y del tejido conjuntivo: osteoporosis después del tratamiento a largo plazo (mayor de 3 meses).
Estudios clínicos con COVID-19
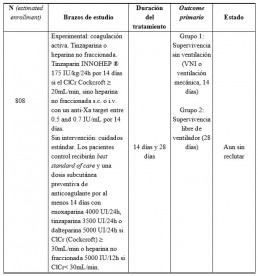
• Trial Evaluating Efficacy and Safety of Anticoagulation in Patients With COVID-19 Infec-tion, Nested in the Corimmuno-19 Cohort8
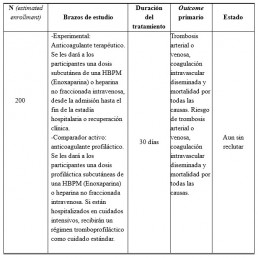
• Preventing COVID-19 Complications With Low- and High-dose Anticoagulation (COVID-HEP) (9)
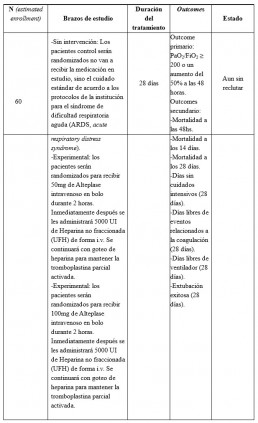
• STudy of Alteplase for Respiratory Failure in SARS-Cov2 (COVID-19) (STARS). (10)
• Austrian CoronaVirus Adaptive Clinical Trial (ACOVACT) (11)

Inserto del producto
(Archivo descargable)
(1) Inserto Lovenox. Food and Drug Administration. 2018. Disponible en:
https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/020164s116lbl.pdf
(2) Inserto Clexane. Agencia Española de Medicamentos y Productos Sanitarios (AEMPs). 2018. Disponible en:
https://cima.aemps.es/cima/dochtml/ft/58502/FT_58502.html
(3) Tang et al. Anticoagulant treatment is associated with decreased mortality in severe corona-virus disease 2019 patients with coagulopathy. 27 de marzo del 2020. J Thromb Haemost. doi: 10.1111/jth.14817.
(4) Tang et al. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. 18 de abril del 2020. J Thromb Haemost. 18(4):844-847. doi: 10.1111/jth.14768. Epub 2020 Mar 13.
(5) Belouzard et al. Activation of the SARS coronavirus spike protein via sequential proteolytic cleavage at two distinct sites. 2009. Proc Natl Acad Sci. 106 (14), 5871-6. doi: 10.1073/pnas.0809524106.
(6) de Haan et al. Murine Coronavirus with an Extended Host Range Uses Heparan Sulfate as an Entry Receptor. Noviembre 2005. J Virol. 79(22): 14451–14456. doi: 10.1128/JVI.79.22.14451-14456.2005
(7) Sistema de Salud Monte Sinaí en Nueva York. 9 de Abril del 2019. Disponible en:
https://emergencymedicinecases.com/wp-content/uploads/2020/04/COVID-19-Anticoagulation-Algorithm-version_final_1.1.pdf
(8) Trial Evaluating Efficacy and Safety of Anticoagulation in Patients With COVID-19 Infec-tion, Nested in the Corimmuno-19 Cohort. Disponible en:
https://clinicaltrials.gov/ct2/show/NCT04344756?term=heparin&cond=COVID&draw=2&rank=1
(9) Preventing COVID-19 Complications With Low- and High-dose Anticoagulation (COVID-HEP). Disponible en:
https://clinicaltrials.gov/ct2/show/NCT04345848?term=heparin&cond=COVID&draw=2&rank=2
(10) STudy of Alteplase for Respiratory Failure in SARS-Cov2 (COVID-19) (STARS). Dispo-nible en:
https://clinicaltrials.gov/ct2/show/NCT04357730?term=heparin&cond=COVID&draw=2&rank=3
(11) Austrian CoronaVirus Adaptive Clinical Trial (ACOVACT). Disponible en:
https://clinicaltrials.gov/ct2/show/NCT04351724?term=heparin&cond=COVID&draw=2&rank=5
Conexion Enoxaparina
Prospecto Enoxaparina
Apixaban
El Apixaban fue aprobado en Estados unidos en 2012. Está indicado para la profilaxis de trombosis venosa profunda (TVP), que puede llevar a un embolismo pulmonar, luego de operaciones de reemplazo de cadera o rodilla; para prevenir el riesgo de stroke y embolias sistémicas en pacientes con fibrilación auricular no valvular; para el tratamiento de trombosis venosa profunda, embolia pulmonar (EP), y para prevenir y para la reducción del riesgo de TVP y EP recurrentes después de la terapia inicial. (1)
Estudios recientes han descrito que la enfermedad COVID-19 se ve complicada por coagulopatía. La coagulación intravascular diseminada (DIC, de sus siglas en inglés Disseminated intravascular coagulation) parece existir en la mayoría de los pacientes que han fallecido por esta enfermedad. Muchos pacientes con COVID-19 cumplen con los criterios de sepsis-3, Third International Consensus Definition for Sepsis. El reposo prolongado por hospitalización y los tratamientos hormonales que son susceptibles a ser administrados en estos pacientes aumentan el riesgo de tromboembolismo venosos (VTE, venous thromboembolism). Es por estas razones que consensos de expertos en China comenzaron a recomendar el tratamiento con anticoagulantes a pacientes con COVID-19 severo. (2)
La disfunción de las células endoteliales inducida por una infección como la del COVID-19 resulta en un exceso de generación de trombina y una parada de la fibrinolisis, lo cual induce al paciente en un estado de hipercoagulación. Además, la hipoxia presente en pacientes COVID-19 severos puede estimular la trombosis, no solo a través del aumento de la viscosidad sanguínea, sino también a tra-vés de la transcripción del factor de transcripción inducible por hipoxia. Las disecciones pulmonares de pacientes COVID-19 han mostrado oclusión y formación de microtrombos en los vasos pequeños del pulmón. (2)
En un estudio realizado por Tang et. al. y publicado en marzo del 2020, se vio que el dímero D, el tiempo de protrombina y la edad están positivamente correlacionadas con la mortalidad por COVID 19 en un análisis multivariante. La mortalidad a los 28 días de los usuarios de heparina fue menor que los no usuarios en pacientes con puntaje SIC (de sus siglas en inglés, Sepsis-induced coagulopathy) ≥4 (40.0% vs 64.2%, p=0.029) y con niveles de dímero D más de seis veces superiores al límite normal (32.8% vs 52.4%, p=0.017). Se concluyó por lo tanto que la terapia anticoagulante (principalmente con HBPM) parece estar asociada con un mejor pronóstico en pacientes graves con COVID-19 que cumplen con criterios SIC o con dímero D notablemente elevados. (2)
En un estudio publicado por Tang et. al. en abril del 2020, se mostró también que los pacientes no-sobrevivientes a COVID-19 mostraban no solo un aumento del dímero D, sino un aumento de los niveles del producto de degradación de la fibrina (FDP, Fibrin degradation product), así como un tiempo de protrombina (PT, Protrombin time) y tiempo de tromboplastina parcial activada (APTT, Activated partial thromboplastin time) más largos en comparación con los sobrevivientes a COVID-19, o con los tiempos presentes en los pacientes al momento de la admisión hospitalaria. El 71.4% de los no-sobrevivientes fueron compatibles con el criterio de coagulación intravascular diseminada durante su hospitalización. Mientras tanto, 0.6% de los pacientes que sobrevivieron fueron compatibles con este criterio. Se concluyó por lo tanto que resultados anormales en la coagulación (especialmente dímero D y FDP elevados), se observan frecuentemente en pacientes con neumonía por coronavirus (NCP, novel coronavirus psneumonia). (3)
Con respecto a la elección del anticoagulante, las heparinas se unen fuertemente a las proteínas de pico COVID-19 (Coronavirus spike proteins, S) y regulan negativamente la IL-6, amortiguando directamente la activación inmune. Los anticoagulantes orales directos (DOAC de sus siglas en inglés Direct Oral Anticoagulants) no parecen tener estas propiedades antiinflamatorias. (4,5)
La Enoxaparina está siendo incluida en algoritmos de pacientes hospitalizados con COVID19, según algoritmo del Sistema de Salud Monte Sinaí en Nueva York: (6)
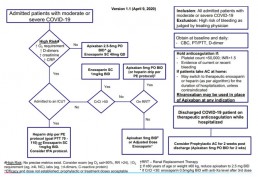
La definición de alto riesgo de progresión a UCI es la siguiente:
– No hay pruebas suficientes para definir con precisión «alto riesgo» o proporcionar valores de corte específicos para factores individuales
– Los médicos deben considerar una combinación de resultados del examen (por ejemplo, respiración dificultosa, RR> 24, disminución O2 sat <90%), mayor requerimiento de O2 (por ejemplo: ≥4L NC) y biomarcadores de laboratorio (por ejemplo: PCR elevada, elevada creatinina, dímero-d ascendente> 1.0).
El Rivaroxaban se puede usar en lugar de Apixaban en este algoritmo
Dosis y administración propuestas para COVID-19
De acuerdo al algoritmo de tratamiento citado anteriormente (6):
• Para los pacientes que no son de alto riesgo (la definición de “Alto riesgo” se encuentra en la imagen), la dosis de Apixaban es de 2.5mg vía oral, dos veces por día.
• Para los pacientes que no son de alto riesgo, con clearence de creatinina≤50 y que no estén en terapia renal de repuesto (RRT, Renal replacement therapy) se recomiendan 5mg de Apixaban vía oral, dos veces por día.
Precauciones y advertencias (1)
• Incremento del riesgo trombótico después de la discontinuación prematura: a interrupción prematura de cualquier anticoagulante oral, en ausencia de anticoagulación alternativa adecuada aumenta el riesgo de eventos trombóticos.
• Sangrado: incrementa el riesgo de sangrado y puede causar sangrados serios y potencialmente fatales. El uso concomitante de medicamentos que afectan la hemostasia aumenta el riesgo de hemorragia
• Anestesia o punción espinal / epidural: cuando se emplea anestesia neuroaxial (anestesia espinal / epidural) o punción espinal / epidural, los pacientes tratados con agentes antitrombóticos para la prevención de complicaciones tromboembólicas corren el riesgo de desarrollar un hematoma epidural o espinal que puede provocar parálisis a largo plazo o permanente.
• Pacientes con válvulas cardíacas protésicas: la seguridad y eficacia de Apixaban no se han estudiado en pacientes con prótesis valvulares cardíacas. Por lo tanto, no se recomienda el uso de Apixaban en estos pacientes.
• EP aguda en pacientes hemodinámicamente inestables o pacientes que requieren trombolisis o embolectomía pulmonar: no se recomienda iniciar Apixaban como alternativa a la heparina no fraccionada para el tratamiento inicial de pacientes con EP que presentan inestabilidad hemodinámica o que pueden recibir trombólisis o embolectomía pulmonar.
• Aumento del riesgo de trombosis en pacientes con síndrome antifosfolípido triple positivo: no se recomienda el uso de anticoagulantes orales de acción directa (ACODs), incluido Apixaban, en pacientes con síndrome antifosfolípido triple positivo (SAF).
• Insuficiencia renal: reducción del riesgo de accidente cerebrovascular y embolia sistémica en pacientes con fibrilación auricular no valvular. La dosis recomendada es de 2.5 mg dos veces al día en pacientes con al menos dos de las siguientes características: edad mayor o igual a 80 años; peso corporal menor o igual a 60 kg; creatinina sérica mayor o igual a 1.5 mg/dL.
• Profilaxis de la trombosis venosa profunda después de una cirugía de reemplazo de cadera o rodilla, y tratamiento de TVP y EP y reducción del riesgo de recurrencia de TVP y EP: no se recomienda ajustar la dosis en pacientes con insuficiencia renal, incluidos aquellos con ERT en diálisis.
• Insuficiencia hepática: no se requiere ajuste de dosis en pacientes con insuficiencia hepática leve (Child-Pugh clase A). Debido a que los pacientes con insuficiencia hepática moderada (Child-Pugh clase B) pueden tener anomalías intrínsecas de la coagulación y la experiencia clínica con Apixaban en estos pacientes es limitada, no se pueden proporcionar recomendaciones de dosificación. Apixaban no se recomienda en pacientes con insuficiencia hepática grave (Child-Pugh clase C)
Eventos adversos (1)
• La reacción adversa más común es el sangrado.
• Aumento del riesgo de eventos trombóticos luego de la suspensión prematura del tratamiento, sangrado y riesgo de desarrollar hematoma espinal o epidural que puede resultar en parálisis prolongada o permanente luego de anestesia o punción espinal o epidural.
• En pacientes bajo tratamiento preventivo de Stroke y embolismo sistémico por fibrilación auricular no valvular el sangrado es una reacción adversa observada. Se evidencia sangrado mayor en localizaciones críticas como: intracraneal, intraespinal, intraocular, pericárdico, intrarticular, intramuscular con síndrome compartimental, sangrado retroperitoneal o fatal. Puede observarse sangrado intracraneal Stroke hemorrágico.
• Otras reacciones adversas observadas son: reacciones de hipersensibilidad y síncope.
• También se observó: náuseas, anemia, contusión, hemorragia , hemorragia post-procedimiento, incremento de la aspartato aminotransferasa y de la GGT.
• Reacciones adversas menos comunes en pacientes tratados con Apixaban: trastornos de la sangre y del sistema linfático: anemia hemorrágica. Trastornos gastrointestinales: hematochezia, hemorragia hemorroidal, gastrointestinal, hematemesis, melena, hemorragia anal. Hemorragia de herida, hemorragia pos-procedimiento, Hematoma traumático, hematoma periorbital. Trastornos musculoesqueléticos y del tejido conjuntivo: hemorragia muscular
• Sistema reproductivo y trastornos mamarios: hemorragia vaginal, metrorragia, menometrorragia, hemorragia genital. Trastornos vasculares: hemorragia. Trastornos de la piel y del tejido subcutáneo: equimosis, hemorragia cutánea, petequias.
• Trastornos oculares: hemorragia conjuntival, hemorragia retiniana, hemorragia ocular
• Sangre en la orina, sangre oculta positiva y glóbulos rojos positivos en orina.
• Trastornos generales y otras afecciones: hematoma, hematoma en el sitio de punción vascular.
Inserto del producto
(1) Inserto Eliquis. Food and Drug Administration. 2019. Disponible en:
https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/202155s024lbl.pdf
(2) Tang et al. Anticoagulant treatment is associated with decreased mortality in severe corona-virus disease 2019 patients with coagulopathy. 27 de marzo del 2020. J Thromb Haemost. doi: 10.1111/jth.14817.
(3) Tang et al. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. 18 de abril del 2020. J Thromb Haemost. 18(4):844-847. doi: 10.1111/jth.14768. Epub 2020 Mar 13.
(4) Belouzard et al. Activation of the SARS coronavirus spike protein via sequential proteolytic cleavage at two distinct sites. 2009. Proc Natl Acad Sci. 106 (14), 5871-6. doi: 10.1073/pnas.0809524106.
(5) de Haan et al. Murine Coronavirus with an Extended Host Range Uses Heparan Sulfate as an Entry Receptor. Noviembre 2005. J Virol. 79(22): 14451–14456. doi: 10.1128/JVI.79.22.14451-14456.2005
(6) Sistema de Salud Monte Sinaí en Nueva York. 9 de Abril del 2019. Disponible en:
https://emergencymedicinecases.com/wp-content/uploads/2020/04/COVID-19-Anticoagulation-Algorithm-version_final_1.1.pdf
Prospecto Apixaban
Farmaco Conexion Apixaban
Análisis mediante RT-PCR demuestran cuánto tiempo se requiere para superar la infección con Covid-19
El virus SARS-CoV-2 ha sido el responsable del desarrollo de la pandemia de Covid-19. Este virus perteneciente a la familia Coronavirus se caracteriza por poseer ARN como material genético y una envoltura viral compuesta de glicoproteínas. Su secuencia genética está publicada de forma gratuita en la base de datos Genebank desde comienzos de 2020.
La detección de este virus se realiza mediante RT-PCR (reverse transcription- polymerase chain reaction). De forma sencilla, esta técnica permite amplificar una muestra de ADN o ARN, utilizando una enzima polimerasa (ARN polimerasa o ADN polimerasa, según la necesidad). En primera instancia se realiza una copia de la cadena complementaria, y luego se amplifica gracias a la utilización de una enzima de transcripción reversa. Esto permite que la técnica sea muy sensible, aún cuando las muestras poseen baja carga genética. Una vez amplificado se analiza la secuencia de las bases nitrogenadas y a través de bancos de datos se caracteriza de qué organismo de trata la muestra. La técnica RT-PCR en tiempo real se utiliza para no solo amplificar el genoma sino también para cuantificarlo.
Esta técnica es la metodología de oro para diagnosticar casos de Covid-19, y es utilizada en distintas etapas de la infección; no solo para determinar su inicio sino también para determinar cuando el paciente efectivamente está dado de alta.
La dinámica viral de la infección viral ha sido estudiada por investigadores de Wuhan, China, utilizando RT-PCR en tiempo real con un kit de detección para ácidos nucleicos de SARS-CoV-2. En particular testearon dos genes: gen ORF1ab y gen de la proteína de la nucleocápside. Si los resultados para ambos genes resultaban negativos, los investigadores lo consideraban como el tiempo de conversión de ácido nucleico viral; y por tanto el tiempo en el cual el paciente dejaba de estar infectado. Para ello tomaron muestras de 56 pacientes hospitalizados que resultaron positivos para el testeo de este virus, a través de un hisopado nasal y de garganta. La edad media de los pacientes fue de 55 años (60% hombres, 40% mujeres). Ninguno requirió de cuidados intensivos y todos estuvieron recuperados y con el alta hospitalaria al final del seguimiento del análisis.
A cada paciente se le realizaron 5 test, y la duración media de los síntomas fue de 24 días (18-31). En la semana 1, el 100% de los resultados fueron positivos, seguidos por el 89.3% en la semana 2, 66.1% en la semana 3, 32.1% en la semana 4, 5.4% en la semana 5 y finalmente 0% en la semana 6. Los resultados muestran que q partir de la semana 3 en adelante, los resultados negativos comenzaron a aumentar considerablemente. Estos resultados sugieren que la replicación viral de SARS-CoV-2 necesita de un período relativamente largo.
Los resultados fueron divididos en grupos según el tiempo de conversión de ácido nucleico. Observaron que aquellos pacientes que demoraron más en presentar resultados negativos se correspondían con tener mayor edad y más comorbilidades, como diabetes e hipertensión.
Bibliografía:
– Xiao, A. T., Tong, Y. X., & Zhang, S. Profile of RT-PCR for SARS-CoV-2: a preliminary study from 56 COVID-19 patients. Clinical Infectious Diseases. 2020. Doi:
10.1093/cid/ciaa460
Conexion Megalabs - Análisis mediante RT-PCR demuestran cuanto tiempo se requiere para superar la infección con Covid-19
Estudio clínico de Remdesivir arroja resultados alentadores respecto al tratamiento de Covid-19
Remdesivir es un fármaco antiviral administrado para tratar el Ébola. Desde 2017 se ha visto que es efectivo para inhibir virus ARN, entre ellos los pertenecientes a la familia de coronavirus. Por este motivo, a partir de la epidemia Covid-19 se ha utilizado para el tratamiento en pacientes infectados con SARS-CoV-2, aunque su efectividad en este virus aún está siendo estudiada in vitro. Diversos estudios clínicos están siendo llevados a cabo para demostrar la efectividad de Remdesivir en tratar pacientes con Covid-19.
Los científicos Estadounidenses Grein y colaboradores, han publicado el 10 de Abril de 2020 los primeros resultados de estos estudios. El estudio liderado por Gilead Sciences colectó información de pacientes infectados con SARS-CoV-2 cuya saturación de oxígeno era inferior al 94%. Los pacientes recibieron Remdesivir durante 10 días, siendo la dosis inicial de 200 mg administrada por vía oral, seguida de dosis de 100 mg vía intravenosa en los días subsiguientes. El estudio fue llevado a cabo desde el 25 de enero hasta el 7 de Marzo de 2020. El estudio de cohorte fue abierto, multicéntrico y adaptativo. Si bien los endpoints no estuvieron pre-determinados, se cuantificó la incidencia de eventos clínicos claves, como cambios en la necesidad de soporte de oxígeno, alta hospitalaria y reporte de eventos adversos. Además, también se evaluó la proporción de pacientes con mejora clínica utilizando una escala ordinal modificada de 6 puntos, según la recomendación de la OMS (WHO R&D Blueprint Group). Dado que el número de participantes no fue previamente calculado, los resultados se expresan como puntos estimados con un intervalo de confianza del 95%.
Fueron analizados 53 pacientes de distintas partes del mundo (Estados Unidos, Italia, Austria, Francia, Alemania, España, Holanda, Canadá y Japón). Dentro de los participantes, el 75% recibió el tratamiento completo con Remdseivir (por 10 días), un 19% recibió terapia durante 5-9 días y un 6% recibió menos de 5 días de tratamiento. El 57% de los participantes estaban recibiendo ventilación mecánica, y un 8% estaban recibiendo oxigenación. Los pacientes fueron seguidos por 18 días (promedio). Se pudo observar que el 68% de los pacientes participantes en el estudio tuvieron una mejora en el tipo de soporte de oxígeno recibido luego de la primera dosis de Remdesivir. Es importante destacar que el 57% de los pacientes que recibían ventilación mecánica fueron extubados.
Respecto a la seguridad del tratamiento con Remdesivir se observó que un 60% reportó eventos adversos. Los más comunes fueron aumento en las enzimas hepáticas, diarrea, eczema, falla renal e hipotensión, y fueron más comunes en aquellos pacientes que recibían ventilación mecánica. Un 23% sufrió eventos adversos serios, dentro de los cuales se destacó el síndrome de disfunción visceral múltiple, shock séptico, falla renal aguda e hipotensión. Estos eventos adversos serios fueron reportados en pacientes que comenzaron el estudio recibiendo ventilación mecánica.
Del total de los participantes, un 47% fue dado de alta y un 13% de los pacientes falleció. La mortalidad fue de un 18 % entre los pacientes que recibieron ventilación invasiva, y de un 5% para el resto de los pacientes. Estudios clínicos con otros tratamientos como Lopinavir+Ritonavir han mostrado mortalidad del 28%, y en otros estudios realizados en China la mortalidad ha variado entre un 17-78%. Teniendo estos hechos presentes, la mortalidad hallada en este estudio junto con los resultados obtenidos permiten ver con esperanza la utilización de este tratamiento en pacientes con Covid-19.
La incidencia acumulada de mejora clínica a los 28 días de seguimiento teniendo en cuenta el puntaje de la escala ordinal o el alta hospitalaria fue de un 84%. Estos resultados son alentadores, pero la interpretación de estos es limitada dado el pequeño número de participantes, la falta de un grupo control para comparar los resultados, y el poco tiempo de tratamiento y seguimiento de los pacientes. Se espera que los sucesivos estudios clínicos que ya están en marcha confirmen estos hallazgos encontrados y le den robustez a la terapia con Remdesivir para pacientes con Covid-19.
Bibliografía:
– Grein J et al. Compassionate Use of Remdesivir for Patients with Severe Covid-19. The New England Journal of Medicine. 2020. Doi: 10.1056/NEJMoa2007016
Conexion Megalabs - Estudio clínico de Remdesivir arroja resultados alentadores respecto al tratamiento de Covid-19

Algoritmo Anticoagulación en pacientes con COVID-19 Mount Sinai
Se han publicado varios trabajos basados en resultados anatomopatológicos que muestran un componente significativo de microangiopatía trombótica, trombosis a nivel de pequeños vasos y hasta signos de coagulación intravascular diseminada en los pacientes que presentan COVID-19.
El 9 de abril del año 2020 se conoció un algoritmo creado por el grupo del hospital Mount Sinai que promueve el uso sistemático de anticoagulación en pacientes con COVID-19 moderado o severo y sin riesgo hemorrágico alto.
Bibliografía:
Mount Sinai COVID-19 Anticoagulation Algorithm Disponible en:
https://emergencymedicinecases.com/wp-content/uploads/2020/04/COVID-19-Anticoagulation-Algorithm-version_final_1.1.pdf
Conexion Megalabs - Algoritmo anticoagulación Mount Sinai
Fluvoxamina
La Fluvoxamina fue aprobada en 1994 en Estados Unidos para tratar a pacientes con trastorno obsesivo compulsivo (TOC).(1) Pertenece al grupo de los inhibidores selectivos de la recaptación de serotonina (ISRS).(2)
En un estudio publicado en 2019 por Rosen et. al., se identifica al receptor Sigma-1 del retículo endoplásmico (S1R) como un inhibidor esencial en la producción de citoquinas en un modelo preclínico de shock séptico. La Fluvoxamina tiene alta afinidad por los receptores S1R, por lo que protege a los ratones del shock séptico y amortigua la respuesta inflamatoria en leucocitos sanguíneos humanos. Los datos obtenidos del estudio de Rosen et. al. muestran la contribución del receptor S1R en la restricción de la respuesta inflamatoria, y posicionan este receptor como un posible objetivo terapéutico para tratar la patología inflamatoria derivada de bacterias.(3)
Existe evidencia que sugiere que pacientes con COVID-19 severo pueden experimentar la cascada enzimática llamada «tormenta de citoquinas». El tratamiento actual de COVID-19 es de apoyo, y la insuficiencia respiratoria causada por el Síndrome de insuficiencia respiratoria aguda (SARS) es la principal causa de mortalidad. La linfohistiocitosis hemofagocítica secundaria es un síndrome hiperinflamatorio, caracterizado por una hipercitoquinemia fulminante con fallo multiorgánico. En adultos, la linfohistiocitosis hemofagocítica secundaria se desencadena con mayor frecuencia por infecciones virales, y ocurre en 3,7–4,3% de los casos de sepsis. Un perfil de citocinas que se asemeja a la linfohistiocitosis hemofagocítica secundaria está asociado con enfermedad de COVID-19 grave, caracterizada por un aumento de la interleucina (IL) -2, IL-7, factor estimulante de colonias de granulocitos, proteína 10 inducible por interferón-γ, proteína quimioatrayente de monocitos 1, proteína inflamatoria de macrófagos 1 -α y factor de necrosis tumoral-α. Los predictores de mortalidad de un reciente estudio retrospectivo y multicéntrico de 150 casos confirmados de COVID-19 en Wuhan, China, incluyeron ferritina e IL-6 elevada, lo que sugiere que la mortalidad podría deberse a hiperinflamación viral.(4)
Los investigadores de la Facultad de Medicina de la Universidad de Washington consideran que la Fluvoxamina podría ayudar a disminuir la inflamación incontrolada que se estima que ocurre en uno de cada siete pacientes con COVID-19 hospitalizados.(5)
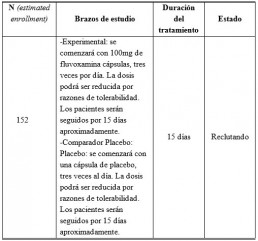
Dicha Universidad está realizando un estudio clínico doble ciego y controlado con placebo, con un total de 152 pacientes sintomáticos y con infección de COVID-19, en Missouri e Illinois.(5)
Dosis y administración propuestas para COVID-19(3)
En el estudio clínico antes mencionado, se comenzará con 100mg de fluvoxamina cápsulas, tres veces por día. La dosis podrá ser reducida por razones de tolerabilidad. Los pacientes serán seguidos por 15 días aproximadamente.
Precauciones y advertencias(1)
• Ideación y comportamiento suicida: la información del producto de la FDA especifica que se debe monitorizar el empeoramiento clínico y el riesgo de suicidio.
• Trastorno bipolar: se debe evaluar si el paciente posee trastorno bipolar.
• Interacciones farmacológicas potencialmente importantes: benzodiazepinas, clozapina, meta-dona, mexiletine, antipsicóticos, ramelteon, teofilina, warfarina, AINEs, aspirina, medica-mentos serotoninérgicos.
• La descontinuación brusca no está recomendada.
• Se visto la activación de la manía / hipomanía.
• Convulsiones: se recomienda evitar administrar fluvoxamina en pacientes con epilepsia ines-table, vigilar pacientes con epilepsia controlada; suspender el tratamiento si ocurren convul-siones o aumenta la frecuencia.
• Hiponatremia: puede ocurrir con los SSRI y los SNRI, incluido Luvox. Las personas mayo-res pueden estar en mayor riesgo. Se recomienda considerar suspender en pacientes con hi-ponatremia sintomática.
• Enfermedad concomitante: se recomienda tener precaución en pacientes con enfermedades o afecciones que afectar las respuestas hemodinámicas o el metabolismo. Los pacientes función hepática disminuida pueden requerir una dosis inicial más baja.
Eventos adversos(1)
Las reacciones más comunes en ensayos controlados con trastorno obsesivo compulsivo y depresión en adultos fueron náuseas, somnolencia, insomnio, astenia, nerviosismo, dispepsia, anormal eyaculación, sudoración, anorexia, temblor y vómitos. Se identificaron también los siguientes eventos adversos: anorgasmia, disminución libido, boca seca, rinitis, perversión del gusto y de la frecuencia urinaria, agitación, depresión, dismenorrea, flatulencia, hipercinesia y erupción cutánea en pacientes pediátricos con TOC.
Estudios clínicos con COVID-19
• A Double-blind, Placebo-controlled Clinical Trial of Fluvoxamine for Symptomatic Individ-uals With COVID-19 Infection (STOP COVID)(3)
(1) Inserto Luvox. Food and Drug Administration. 2008. Disponible en:
https://www.accessdata.fda.gov/drugsatfda_docs/label/2008/022235lbl.pdf
(2) Committee for Proprietary Medicinal Products (CPMP). Summary information on referral opinion following arbitration pursuant to article 30 of Council Directive 2001/83/EC for Floxyfral and associated names. Internationa NonProprietary Name (INN): fluvoxamine. Background information. EMEA/CPMP/600/02/en/Final. 25 de Julio 2012. Disponible en:
https://www.ema.europa.eu/en/documents/referral/summary-information-referral-opinion-following-arbitration-pursuant-article-30-council-directive/83/ec-floxyfral-associated-names-international-non-proprietary-name-inn-fluvoxamine-background_en.pdf
(3) Dorian A Rosen, Scott M. Seki, Anthony Fernández-Castañeda, Rebecca M. Beiter, Jacob D. Eccles, Judith A. Woodfolk, Alban Gaultier. Modulation of the Sigma-1 Receptor-IRE1 pathway is beneficial in preclinical models of inflammation and sepsis. Sci Transl Med. 6 de febrero del 2019. 11(478). doi:
https://doi.org/10.1126/scitranslmed.aau5266
(4) Puja Mehta, Daniel F McAuley, Michael Brown, Emilie Sanchez, Rachel S Tattersall, Jessica J Manson et al. COVID-19: consider cytokine storm syndromes and immunosuppression. The Lancet. 16 de marzo del 2020. doi:
https://doi.org/10.1016/S0140-6736(20)30628-0
(5) A Double-blind, Placebo-controlled Clinical Trial of Fluvoxamine for Symptomatic Individ-uals With COVID-19 Infection (STOP COVID). Disponible en:
https://clinicaltrials.gov/ct2/show/NCT04342663
Fluvoxamina Farmacos
Facultad de Medicina de Universidad de Yale
La Facultad de Medicina de la Universidad de Yale actualiza protocolo de tratamiento para uso de enoxaparina y apixaban en el tratamiento de COVID-19.
Disponible en:
https://covid.yale.edu/document-feedback/17/
https://files-profile.medicine.yale.edu/documents/dcd9418b-d422-4f4d-84de-41dedb310420
Protocolo Yale