Síndrome de COVID-19 post-agudo
Ani Nalbandian, Kartik Sehgal, […] Elaine Y. Wan
Nature Medicine (2021)
https://doi.org/10.1038/s41591-021-01283-z
Artículo de revisión
Publicado: 22 de marzo de 2021
Resumen
El coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2) es el patógeno responsable de la pandemia de la enfermedad del coronavirus 2019 (COVID-19), que ha provocado crisis de atención médica global y sobrecarga de los recursos sanitarios. A medida que crece la población de pacientes que se recuperan de COVID-19, es fundamental comprender los problemas de atención médica que los rodean. COVID-19 ahora se reconoce como una enfermedad de múltiples órganos con un amplio espectro de manifestaciones. De manera similar a los síndromes virales posagudos descritos en sobrevivientes de otras epidemias de coronavirus virulentos, hay informes cada vez mayores de efectos persistentes y prolongados después del COVID-19 agudo. Los grupos de defensa de los pacientes, muchos de los cuales se identifican a sí mismos como portadores de larga duración, han ayudado a contribuir al reconocimiento del COVID-19 posagudo, un síndrome caracterizado por síntomas persistentes y / o complicaciones tardías o a largo plazo más allá de las 4 semanas desde el inicio de la enfermedad. Aquí, proporcionamos una revisión completa de la literatura actual sobre COVID-19 posagudo, su fisiopatología y sus secuelas específicas en órganos. Finalmente, discutimos las consideraciones relevantes para la atención multidisciplinaria de los sobrevivientes de COVID-19 y proponemos un marco para la identificación de aquellos en alto riesgo de COVID-19 posagudo y su manejo coordinado a través de clínicas dedicadas al COVID-19.
Principal
El coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2), el patógeno responsable de la enfermedad por coronavirus 2019 (COVID-19), ha causado morbilidad y mortalidad a una escala sin precedentes a nivel mundial. La evidencia científica y clínica está evolucionando sobre los efectos subagudos y a largo plazo del COVID-19, que puede afectar múltiples sistemas de órganos. Los primeros informes sugieren efectos residuales de la infección por SARS-CoV-2, como fatiga, disnea, dolor en el pecho, alteraciones cognitivas, artralgia y deterioro de la calidad de vida. El daño celular, una sólida respuesta inmune innata con producción de citocinas inflamatorias y un estado procoagulante inducido por la infección por SARS-CoV-2 pueden contribuir a estas secuelas. Los sobrevivientes de infecciones anteriores por coronavirus, incluida la epidemia de SARS de 2003 y el brote de síndrome respiratorio de Oriente Medio (MERS) de 2012, han demostrado una constelación similar de síntomas persistentes, lo que refuerza la preocupación por las secuelas clínicamente significativas de COVID-19.
Se necesita un estudio sistemático de las secuelas después de la recuperación de COVID-19 agudo para desarrollar un enfoque de equipo multidisciplinario basado en la evidencia para el cuidado de estos pacientes y para informar las prioridades de investigación. Una comprensión integral de las necesidades de atención del paciente más allá de la fase aguda ayudará en el desarrollo de la infraestructura para las clínicas COVID-19 que estarán equipadas para brindar atención integrada de múltiples especialidades en el entorno ambulatorio. Si bien la definición de la línea de tiempo posaguda de COVID-19 está evolucionando, se ha sugerido que incluya la persistencia de síntomas o el desarrollo de secuelas más allá de las 3 o 4 semanas desde el inicio de los síntomas agudos de COVID-19, ya que el SARS-CoV-2 con capacidad de replicación no se ha aislado después de 3 semanas. A los efectos de esta revisión, se definió el COVID-19 posagudo como los síntomas persistentes o las complicaciones tardías o a largo plazo de la infección por el SARS-CoV-2 más allá de las 4 semanas desde el inicio de los síntomas.
Con base en la literatura reciente, se divide en dos categorías:
(1) COVID-19 sintomático subagudo o continuo, que incluye síntomas y anomalías presentes de 4 a 12 semanas después del COVID-19 agudo; y
(2) síndrome crónico o post-COVID-19, que incluye síntomas y anomalías que persisten o están presentes más allá de las 12 semanas del inicio del COVID-19 agudo y no atribuibles a diagnósticos alternativos. Aquí, resumimos la epidemiología y las secuelas específicas de órganos del COVID-19 posagudo y abordamos las consideraciones de manejo para la atención integral interdisciplinaria de estos pacientes en las clínicas de COVID-19.
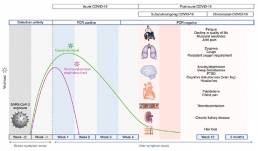
Epidemiología
Han surgido informes iniciales sobre las consecuencias infecciosas posagudas del COVID-19, con estudios de los Estados Unidos, Europa y China que informan sobre los resultados de quienes sobrevivieron a la hospitalización por COVID-19 agudo. Los hallazgos de los estudios que informaron los resultados en el síndrome COVID-19 sintomático subagudo / continuo y el síndrome crónico / posterior al COVID-19 se resumen en la Tabla 1.
Un estudio de cohorte observacional de 38 hospitales en Michigan, Estados Unidos, evaluó los resultados en 1250 pacientes dados de alta con vida a los 60 días mediante el uso de registros médicos y encuestas telefónicas (en lo sucesivo, el estudio estadounidense posagudo COVID-19). Durante el período de estudio, el 6,7% de los pacientes falleció, mientras que el 15,1% de los pacientes requirió reingreso. De 488 pacientes que completaron la encuesta telefónica en este estudio, el 32,6% de los pacientes informaron síntomas persistentes, incluido el 18,9% con síntomas nuevos o que empeoraron. La disnea al subir escaleras (22,9%) fue la más común, mientras que otros síntomas incluyeron tos (15,4%) y pérdida persistente del gusto y/o del olfato (13,1%).
Se informaron hallazgos similares de estudios en Europa. Un servicio ambulatorio posagudo establecido en Italia (en lo sucesivo denominado estudio italiano posagudo COVID-19) informó la persistencia de los síntomas en el 87,4% de 143 pacientes dados de alta del hospital que se recuperaron de un COVID-19 agudo en un seguimiento medio hasta 60 dias desde el inicio del primer síntoma. La fatiga (53,1%), la disnea (43,4%), el dolor articular (27,3%) y el dolor en el pecho (21,7%) fueron los síntomas informados con mayor frecuencia, y el 55% de los pacientes continuaron experimentando tres o más síntomas. Se observó una disminución en la calidad de vida, medida por la escala analógica visual EuroQol, en el 44,1% de los pacientes de este estudio. Un estudio centrado en 150 supervivientes de COVID-19 no crítico de Francia informó de manera similar la persistencia de los síntomas en dos tercios de las personas a los 60 días de seguimiento, y un tercio informó sentirse peor que al inicio del COVID-19 agudo.
Otros estudios, incluidos los estudios de seguimiento prospectivo presencial de 110 supervivientes en el Reino Unido a las 8-12 semanas después del ingreso hospitalario y 277 supervivientes en España a las 10-14 semanas del inicio de la enfermedad, así como estudios de encuesta de 100 supervivientes de COVID- 19 en el Reino Unido a las 4-8 semanas después del alta, 183 individuos en los Estados Unidos a los 35 días después del alta y 120 pacientes dados de alta del hospital en Francia, a los 100 días después del ingreso, informaron hallazgos similares.
Se observaron fatiga, disnea y angustia psicológica, como trastorno de estrés postraumático (TEPT), ansiedad, depresión y anomalías de concentración y del sueño, en aproximadamente el 30% o más de los participantes del estudio en el momento del seguimiento.
En un estudio de cohorte prospectivo de Wuhan, China, las consecuencias a largo plazo del COVID-19 agudo se evaluaron mediante una evaluación integral en persona de 1,733 pacientes a los 6 meses de la aparición de los síntomas (en lo sucesivo, el estudio chino posagudo del COVID-19). El estudio utilizó cuestionarios de encuesta, examen físico, pruebas de marcha de 6 min (PM6M) y análisis de sangre y, en casos seleccionados, pruebas de función pulmonar (PFT), tomografía computarizada de alta resolución del tórax y ecografía para evaluar el COVID posagudo. La mayoría de los pacientes (76%) informó al menos un síntoma. Al igual que en otros estudios, la fatiga / debilidad muscular fue el síntoma más comúnmente informado (63%), seguido de las dificultades para dormir (26%) y la ansiedad / depresión (23%).
Estos estudios proporcionan evidencia preliminar para ayudar a identificar a las personas con alto riesgo de COVID-19 posagudo. La gravedad de la enfermedad durante el COVID-19 agudo (medida, por ejemplo, por la admisión a una unidad de cuidados intensivos (UCI) y / o la necesidad de ventilación mecánica no invasiva y / o invasiva) se ha asociado significativamente con la presencia o persistencia de síntomas (como disnea, fatiga / debilidad muscular y trastorno de estrés postraumático), reducción en las puntuaciones de calidad de vida relacionadas con la salud, anomalías de la función pulmonar y anomalías radiográficas en el entorno posagudo de COVID-19. Además, Halpin et al. informaron asociaciones adicionales entre enfermedad respiratoria preexistente, índice de masa corporal más alto, edad avanzada y orige étnico negro, asiático y de minorías étnicas, y disnea a las 4-8 semanas de seguimiento.
El estudio chino posagudo de COVID-19 también sugirió diferencias de sexo, con mujeres más propensas a experimentar fatiga y ansiedad / depresión a los 6 meses de seguimiento, similar a las sobrevivientes de SARS. Si bien otras comorbilidades, como la diabetes, la obesidad, la enfermedad cardiovascular o renal crónica, el cáncer y el trasplante de órganos, son determinantes bien reconocidos del aumento de la gravedad y la mortalidad relacionadas con el COVID-19 agudo, su asociación con Los resultados agudos de COVID-19 en aquellos que se han recuperado aún están por determinarse.
Fisiopatología
Los mecanismos fisiopatológicos predominantes del COVID-19 agudo incluyen los siguientes: toxicidad viral directa; daño endotelial y daño microvascular; desregulación del sistema inmunológico y estimulación de un estado hiperinflamatorio; hipercoagulabilidad con trombosis y macrotrombosis in situ resultantes; y mala adaptación de la vía 2 de la enzima convertidora de angiotensina (ACE2). La superposición de las secuelas del COVID-19 posagudo con las del SARS y el MERS puede explicarse por similitudes filogenéticas entre los coronavirus patógenos responsables. La superposición de la identidad de secuencia genómica de SARS-CoV-2 es del 79% con SARS-CoV-1 y del 50% con MERS-CoV.
Además, el SARS-CoV-1 y el SARS-CoV-2 comparten el mismo receptor de la célula huésped: ACE2. Sin embargo, existen diferencias notables, como la mayor afinidad del SARS-CoV-2 por ACE2 en comparación con el SARS-CoV-1, que probablemente se deba a diferencias en el dominio de unión al receptor de la proteína de espiga que media el contacto con ACE2.
En contraste con los otros genes estructurales, el gen de la espiga ha divergido en el SARS-CoV-2, con solo un 73% de similitud de aminoácidos con el SARS-CoV-1 en el dominio de unión al receptor de la proteína de espiga. Además, un sitio de escisión adicional S1-S2 en el SARS-CoV-2 permite una escisión más eficaz por parte de las proteasas del huésped y facilita una unión más eficaz. Estos mecanismos probablemente han contribuido a una transmisión más eficaz y generalizada del SARS-CoV-2.
Los posibles mecanismos que contribuyen a la fisiopatología del COVID-19 posagudo incluyen:
(1) cambios fisiopatológicos específicos del virus;
(2) aberraciones inmunológicas y daño inflamatorio en respuesta a la infección aguda; y
(3) secuelas esperadas de una enfermedad poscrítica.
Si bien los dos primeros se analizan con más detalle en las secciones específicas de órganos a continuación, el síndrome post-cuidados intensivos ahora es bien reconocido e incluye anomalías nuevas o que empeoran en los dominios físicos, cognitivos y psiquiátricos después de una enfermedad crítica.
La fisiopatología del síndrome post-cuidados intensivos es multifactorial y se ha propuesto que implica isquemia y lesión microvascular, inmovilidad y alteraciones metabólicas durante la enfermedad crítica. Además, al igual que en estudios previos de sobrevivientes de SARS, el 25-30% de los cuales experimentaron infecciones secundarias, los sobrevivientes de COVID-19 agudo pueden tener un mayor riesgo de infecciones bacterianas, fúngicas (aspergilosis pulmonar) u otros patógenos. Sin embargo, estas infecciones secundarias no explican las secuelas persistentes y prolongadas del COVID-19 posagud.
Secuelas pulmonares
Epidemiología y manifestaciones clínicas.
Entre los supervivientes de COVID-19 se ha informado de un espectro de manifestaciones pulmonares, que van desde disnea (con o sin dependencia crónica de oxígeno) hasta destete difícil del ventilador y daño pulmonar fibrótico. Al igual que los supervivientes del síndrome de dificultad respiratoria aguda (SDRA) de otras etiologías, la disnea es el síntoma persistente más común después del COVID-19 agudo, con una prevalencia del 42-66% a los 60-100 días de seguimiento. En el estudio chino post-agudo COVID-19, la mediana de la distancia de caminata de 6 minutos fue menor que los valores de referencia normales en aproximadamente una cuarta parte de los pacientes a los 6 meses, una prevalencia similar a la de los sobrevivientes de SARS y MERS. La necesidad de oxígeno suplementario debido a la hipoxemia persistente, o la nueva necesidad de presión positiva continua en las vías respiratorias u otro soporte respiratorio mientras duerme, se informó en el 6,6 y el 6,9% de los pacientes, respectivamente, a los 60 días de seguimiento en la fase posaguda de COVID 19 en el estudio de EE. UU.
De los 1.800 pacientes que requirieron traqueostomías durante el COVID-19 agudo, solo el 52% fueron retirados con éxito de la ventilación mecánica un mes después en un estudio de cohorte nacional de España. La reducción en la capacidad de difusión es el deterioro fisiológico informado con más frecuencia en el COVID-19 posagudo, con una disminución significativa directamente relacionada con la gravedad de la enfermedad aguda, lo cual es consistente con estudios de sobrevivientes de SARS y MERS, sobrevivientes de influenza leve H1N1 y sobrevivientes históricos de SDRA. Aunque es menos común, se ha encontrado que los sobrevivientes de COVID-19 hospitalizados tienen fisiología pulmonar restrictiva a los 3 y 6 meses, lo que también se ha observado en poblaciones históricas de sobrevivientes de SDRA.
Aproximadamente el 50% de los 349 pacientes que se sometieron a una tomografía computarizada de alta resolución del tórax a los 6 meses tenían al menos un patrón anormal en el estudio chino de COVID-19 post-agudo. La mayoría de las anomalías observadas por tomografía computarizada fueron opacidades en vidrio esmerilado. Este estudio no investigó la embolia pulmonar crónica ya que no se obtuvieron angiogramas pulmonares por tomografía computarizada. En este momento se desconocen los riesgos a largo plazo de embolia pulmonar crónica y la consiguiente hipertensión pulmonar. Tres meses después del alta hospitalaria, se observaron cambios fibróticos en las tomografías computarizadas de tórax, que consisten principalmente en reticulaciones o bronquiectasias por tracción, en aproximadamente el 25 y el 65% de los sobrevivientes en estudios de cohortes de casos leves a moderados y en su mayoría casos graves, respectivamente, que se distingue por la necesidad de oxígeno suplementario. Sin embargo, estas estimaciones de prevalencia deben considerarse preliminares dado el tamaño de la muestra de cada una de estas cohortes. Las estimaciones de prevalencia de las secuelas de COVID-19 posagudo de estos estudios sugieren que los pacientes con mayor gravedad de COVID-19 agudo (especialmente aquellos que requieren una cánula nasal de alto flujo y ventilación mecánica no invasiva o invasiva) tienen el mayor riesgo de complicaciones pulmonares a largo plazo, que incluyen deterioro persistente de la difusión y anomalías pulmonares radiográficas (como fibrosis pulmonar).
Patología y fisiopatología
Los mecanismos virales dependientes (incluida la invasión de células endoteliales y epiteliales alveolares por el SARS-CoV-2) y los mecanismos virales independientes (como el daño inmunológico, incluida la inflamación perivascular) contribuyen a la ruptura de la barrera endotelial-epitelial con invasión de monocitos, neutrófilos y extravasación de un exudado rico en proteínas en el espacio alveolar, compatible con otras formas de SDRA. Todas las fases del daño alveolar difuso se han reportado en series de autopsias de COVID-19, con daño alveolar difuso fibroproliferativo focal y organizativo visto más adelante en el curso de la enfermedad, consistente con otras etiologías de SDRA. También se han observado áreas raras de proliferación de miofibroblastos, fibrosis mural y formación de panales microquísticos. Este estado fibrótico puede ser provocado por citocinas como la interleucina-6 (IL-6) y el factor de crecimiento transformante-β, que han sido implicados en el desarrollo de fibrosis pulmonar y puede predisponer a la colonización bacteriana y posterior infección. El análisis de tejido pulmonar de cinco casos con neumonía grave asociada a COVID-19, incluidas dos muestras de autopsia y tres muestras de pulmones explantados de receptores de trasplante de pulmón, mostró patrones de expresión histopatológicos y unicelulares de ARN similares a la fibrosis pulmonar en etapa terminal sin persistencia Infección por SARS-CoV-2, lo que sugiere que algunos individuos desarrollan fibrosis pulmonar acelerada después de la resolución de la infección activa.
Se han observado microtrombosis y macrotrombosis vasculares pulmonares en el 20-30% de los pacientes con COVID-19, que es mayor que en otras poblaciones de pacientes críticos (1-10%). Además, la gravedad de la lesión endotelial y la trombosis generalizada con microangiopatía observada en la autopsia pulmonar es mayor que la observada en el SDRA por influenza.
Consideraciones de manejo
La atención al alta hospitalaria de los supervivientes de COVID-19 ha sido reconocida como una de las principales prioridades de investigación por parte de organizaciones profesionales, y la orientación para el tratamiento de estos pacientes aún está en evolución. Se ha sugerido que la oximetría de pulso domiciliaria con dispositivos aprobados por la Administración de Alimentos y Medicamentos es una herramienta útil para monitorear a los pacientes con síntomas persistentes; sin embargo, actualmente se carece de evidencia de apoyo. Algunos expertos también han propuesto la evaluación con PFT seriadas y 6MWT (prueba de marcha de seis minutos) para aquellos con disnea persistente, así como tomografía computarizada de alta resolución de tórax a los 6 y 12 meses.
En un documento de orientación adoptado por la British Thoracic Society, los algoritmos para evaluar a los sobrevivientes de COVID-19 en los primeros 3 meses después del alta hospitalaria se basan en la gravedad del COVID-19 agudo y si el paciente recibió o no atención en la UCI. Los algoritmos para los grupos de COVID-19 grave y leve a moderado recomiendan la evaluación clínica y la radiografía de tórax en todos los pacientes a las 12 semanas, junto con la consideración de PFT, 6MWT, muestreo de esputo y ecocardiograma de acuerdo con el juicio clínico. Con base en esta evaluación a 12 semanas, se recomienda que los pacientes sean evaluados con tomografía computarizada de alta resolución del tórax, angiografía pulmonar por tomografía computarizada o ecocardiograma, o que sean dados de alta del seguimiento. Además de esta evaluación de 12 semanas, también se recomienda una evaluación clínica más temprana de las secuelas respiratorias, psiquiátricas y tromboembólicas, así como de las necesidades de rehabilitación, a las 4-6 semanas después del alta para aquellos pacientes con COVID-19 agudo grave, definido como aquellos pacientes que tuvieron neumonía grave, requirieron atención en UCI, son ancianos o tienen múltiples comorbilidades.
El tratamiento con corticosteroides puede ser beneficioso en un subconjunto de pacientes con enfermedad pulmonar inflamatoria posterior a COVID, como sugiere una observación preliminar de una mejora significativa sintomática y radiológica en una pequeña cohorte del Reino Unido de sobrevivientes de COVID-19 con neumonía organizada a las 6 semanas después del alta hospitalaria. El uso de esteroides durante el COVID-19 agudo no se asoció con alteraciones de la difusión ni anomalías radiográficas a los 6 meses de seguimiento en el estudio chino posagudo de COVID19.
El trasplante de pulmón se ha realizado previamente para la enfermedad pulmonar fibroproliferativa después del SDRA debido a la infección por influenza A (H1N1 ) y COVID-19. Se están realizando ensayos clínicos de terapias antifibróticas para prevenir la fibrosis pulmonar después del COVID-19
Secuelas hematológicas
Epidemiología y manifestaciones clínicas.
Los datos retrospectivos sobre eventos tromboembólicos posagudos, aunque limitados por el pequeño tamaño de la muestra, la variabilidad en la determinación de los resultados y el seguimiento sistemático inadecuado, sugieren que la tasa de tromboembolismo venoso (TEV) en el contexto posagudo de COVID-19 es <5% . Un informe de un solo centro de 163 pacientes de los Estados Unidos sin tromboprofilaxis posterior al alta sugirió una incidencia acumulada de trombosis del 2,5% a los 30 días después del alta, que incluyó embolia pulmonar segmentaria, trombo intracardíaco, fístula arteriovenosa trombosada e ictus isquémico. La mediana de duración de estos eventos fue de 23 días después del alta. En este mismo estudio, hubo una incidencia acumulada de hemorragia del 3,7% a los 30 días del alta, principalmente relacionada con caídas mecánicas. Se han informado tasas similares de TEV en estudios retrospectivos del Reino Unido. Un estudio prospectivo de Bélgica a las 6 semanas de seguimiento posterior al alta evaluó los niveles de dímero D y la ecografía venosa en 102 pacientes. El 8% recibió tromboprofilaxis tras el alta. Sólo se informó un evento de TEV asintomático. De manera similar, no se observó TVP en 390 participantes (seleccionados mediante un procedimiento de muestreo estratificado para incluir a aquellos con una mayor gravedad de COVID-19 agudo) a quienes se les realizó una ecografía de las extremidades inferiores en el estudio chino posagudo del COVID-19.
Los estudios en curso más amplios, como CORONA-VTE, CISCO-19 y CORE-19, ayudarán a establecer tasas más definitivas de tales complicaciones.
Patología y fisiopatología
A diferencia de la coagulopatía de consumo característica de la coagulación intravascular diseminada, la coagulopatía asociada a COVID-19 es compatible con un estado hiperinflamatorio e hipercoagulable. Esto puede explicar las tasas desproporcionadamente altas (20-30%) de complicaciones trombóticas en lugar de hemorrágicas en el COVID-19 agudo. Los mecanismos de tromboinflamación incluyen lesión endotelial, activación del complemento, activación plaquetaria e interacciones plaquetas-leucocitos, trampas extracelulares de neutrófilos, liberación de citocinas proinflamatorias, interrupción de las vías coagulantes normales e hipoxia, similar a la fisiopatología de los síndromes de microangiopatía trombótica.
El riesgo de complicaciones trombóticas en la fase posaguda de COVID-19 probablemente esté relacionado con la duración y gravedad de un estado hiperinflamatorio, aunque se desconoce cuánto tiempo persiste.
Consideraciones de manejo
Aunque aún no se dispone de evidencia concluyente, el alta poshospitalaria prolongada (hasta 6 semanas) y la tromboprofilaxis primaria prolongada (hasta 45 días) en aquellos tratados como pacientes ambulatorios pueden tener una relación riesgo-beneficio más favorable en COVID-19, dado el mencionado aumento de las complicaciones trombóticas durante la fase aguda, y esta es un área de investigación activa (NCT04508439, COVID-PREVENT (NCT04416048), ACTIV4 (NCT04498273) y PREVENT-HD (NCT04508023)). Los niveles elevados de dímero D (más del doble del límite superior de lo normal), además de las comorbilidades como el cáncer y la inmovilidad, pueden ayudar a estratificar el riesgo de los pacientes con mayor riesgo de trombosis posaguda; sin embargo, las consideraciones de riesgo versus beneficio a nivel de paciente individual deben dictar recomendaciones en este momento. Los anticoagulantes orales directos y la heparina de bajo peso molecular son agentes anticoagulantes preferidos sobre los antagonistas de la vitamina K debido a la falta de necesidad de monitorizar con frecuencia los niveles terapéuticos, así como al menor riesgo de interacciones fármaco-fármaco. Se recomienda la anticoagulación terapéutica para aquellos con TEV confirmada por imágenes durante ≥3 meses. El papel de los agentes antiplaquetarios como el ácido acetilsalicílico como alternativa (o junto con agentes anticoagulantes) para la tromboprofilaxis en COVID-19 aún no se ha definido y actualmente se está investigando como una estrategia de tromboprofilaxis primaria prolongada en pacientes tratados de forma ambulatoria (ACTIV4 (NCT04498273 )). Se debe recomendar la actividad física y la deambulación a todos los pacientes cuando sea apropiado
Secuelas cardiovasculares
Epidemiología y manifestaciones clínicas.
Se informó dolor torácico en hasta ~ 20% de los supervivientes de COVID-19 a los 60 días de seguimiento, mientras que se notificaron palpitaciones y dolor torácico en curso en el 9 y el 5%, respectivamente, a los 6 meses de seguimiento en el período posterior en el estudio chino agudo COVID-19. Se ha observado una mayor incidencia de miocardiopatía por estrés durante la pandemia de COVID-19 en comparación con los períodos prepandémicos (7,8 frente a 1,5-1,8%, respectivamente), aunque las tasas de mortalidad y reingreso en estos pacientes son similares. Los datos preliminares con imágenes de resonancia magnética cardíaca (IRM) sugieren que la inflamación del miocardio en curso puede estar presente en tasas tan altas como 60% más de 2 meses después de un diagnóstico de COVID-19 en un centro de pruebas de COVID, aunque la reproducibilidad y consistencia de estos datos han sido debatidas.
En un estudio de 26 atletas universitarios de competición con infección leve o asintomática por SARS-CoV-2, la resonancia magnética cardíaca reveló características diagnósticas de miocarditis en el 15% de los participantes y lesión miocárdica previa en el 30,8% de los participantes.
Patología y fisiopatología
Los mecanismos que perpetúan las secuelas cardiovasculares en el COVID-19 posagudo incluyen la invasión viral directa, la regulación a la baja de la ECA2, la inflamación y la respuesta inmunológica que afecta la integridad estructural del miocardio, el pericardio y el sistema de conducción. Los estudios de autopsia en 39 casos de COVID-19 detectaron virus en el tejido cardíaco del 62,5% de los pacientes. La respuesta inflamatoria subsiguiente puede conducir a la muerte de los cardiomiocitos y al desplazamiento fibrograso de las proteínas desmosomales importantes para la adherencia de célula a célula.
Los pacientes recuperados pueden haber aumentado de forma persistente la demanda cardiometabólica, como se observa en la evaluación a largo plazo de los supervivientes del SARS. Esto puede estar asociado con una reserva cardíaca reducida, uso de corticosteroides y desregulación del sistema renina-angiotensina-aldosterona (RAAS). La fibrosis o cicatrización del miocardio y la miocardiopatía resultante de una infección viral pueden provocar arritmias por reentrada. COVID-19 también puede perpetuar las arritmias debido a un estado catecolaminérgico elevado debido a citocinas como IL-6, IL-1 y factor de necrosis tumoral-α, que pueden prolongar los potenciales de acción ventricular al modular la expresión del canal iónico de los cardiomiocitos. La disfunción autónoma después de una enfermedad viral, que da como resultado el síndrome de taquicardia ortostática postural y taquicardia sinusal inapropiada, se ha informado previamente como resultado de la modulación adrenérgica.
Consideraciones de manejo
Se puede considerar la evaluación clínica y de imagen en serie con electrocardiograma y ecocardiograma a las 4-12 semanas en aquellos con complicaciones cardiovasculares durante una infección aguda o síntomas cardíacos persistentes. La evidencia actual no respalda la utilización rutinaria de imágenes cardíacas avanzadas, pero esto debe considerarse caso por caso.
Las recomendaciones para los atletas de competición con complicaciones cardiovasculares relacionadas con COVID-19 incluyen la abstinencia de deportes de competición o actividad aeróbica durante 3-6 meses hasta la resolución de la inflamación miocárdica mediante RM cardíaca o normalización de troponina.
A pesar de las preocupaciones teóricas iniciales con respecto al aumento de los niveles de ACE2 y el riesgo de COVID-19 agudo con el uso de inhibidores de RAAS, se ha demostrado que son seguros y deben continuarse en aquellos con enfermedad cardiovascular estable. En cambio, el cese abrupto de los inhibidores de RAAS puede ser potencialmente dañino. En pacientes con disfunción ventricular, la terapia médica dirigida por las guías debe iniciarse y optimizarse según la tolerancia. La retirada de la terapia médica dirigida por las guías se asoció con una mayor mortalidad en la fase aguda a posaguda en un estudio retrospectivo de 3.080 pacientes con COVID-19. Los pacientes con síndrome de taquicardia ortostática postural y taquicardia sinusal inapropiada pueden beneficiarse de un betabloqueante de dosis baja para controlar la frecuencia cardíaca y reducir la actividad adrenérgica. Se debe prestar atención al uso de fármacos como agentes antiarrítmicos (por ejemplo, amiodarona) en pacientes con cambios pulmonares fibróticos después de COVID-19.
Secuelas neuropsiquiátricas
Epidemiología y manifestaciones clínicas.
Al igual que el síndrome post-SARS crónico, los supervivientes de COVID-19 han informado de un síndrome post-viral de malestar crónico, mialgia difusa, síntomas depresivos y sueño no reparador. Otras manifestaciones post-agudas de COVID-19 incluyen dolores de cabeza similares a las migrañas (a menudo refractarios a los analgésicos tradicionales) y dolores de cabeza de inicio tardío atribuidos a niveles altos de citocinas. En un estudio de seguimiento de 100 pacientes, aproximadamente el 38% tenía dolores de cabeza continuos después de 6 semanas. La pérdida del gusto y el olfato también puede persistir después de la resolución de otros síntomas en aproximadamente una décima parte de los pacientes hasta los 6 meses de seguimiento. Se ha observado deterioro cognitivo con o sin fluctuaciones, incluida la confusión mental, que puede manifestarse como dificultades con la concentración, la memoria, la percepción
Las personas con COVID-19 experimentan una variedad de síntomas psiquiátricos que persisten o se presentan meses después de la infección inicial. En una cohorte de 402 sobrevivientes de COVID-19 en Italia un mes después de la hospitalización, aproximadamente el 56% resultó positivo en al menos uno de los dominios evaluados para secuelas psiquiátricas (TEPT, depresión, ansiedad, insomnio y sintomatología obsesivo compulsiva). Se informó depresión y ansiedad clínicamente significativas en aproximadamente el 30-40% de los pacientes después de COVID-19, similar a los pacientes con infecciones previas por coronavirus graves.
La ansiedad, la depresión y las dificultades para dormir estuvieron presentes en aproximadamente una cuarta parte de los pacientes a los 6 meses de seguimiento en el estudio chino post-agudo COVID-19. En particular, se informaron síntomas de TEPT clínicamente significativos en aproximadamente el 30% de los pacientes con COVID-19 que requirieron hospitalización y pueden presentarse temprano durante la infección aguda o meses después. Un análisis de conjunto de datos a gran escala del mundo real de 62.354 sobrevivientes de COVID-19 de 54 organizaciones de atención médica en los Estados Unidos estimó que la incidencia de la primera enfermedad psiquiátrica y recurrente entre los 14 y 90 días del diagnóstico fue del 18,1%. Más importante aún, informó que la probabilidad general estimada de diagnóstico de una nueva enfermedad psiquiátrica dentro de los 90 días posteriores al diagnóstico de COVID-19 era del 5,8% (trastorno de ansiedad = 4,7%; trastorno del estado de ánimo = 2%; insomnio = 1,9%; demencia (entre los ≥65 años) = 1,6%) entre un subconjunto de 44.759 pacientes sin enfermedad psiquiátrica previa conocida. Estos valores fueron todos significativamente más altos que en las cohortes de control emparejadas de pacientes diagnosticados con influenza y otras infecciones del tracto respiratorio.
Al igual que en otras enfermedades críticas, las complicaciones del COVID-19 agudo, como el ictus isquémico o hemorrágico, el daño hipóxico-anóxico, el síndrome de encefalopatía posterior reversible y la mielitis aguda diseminada, pueden conducir a déficits neurológicos persistentes o permanentes que requieran una rehabilitación extensa. Además, la miopatía y las neuropatías de la enfermedad crítica aguda que resultan de la COVID-19 aguda o del efecto de los agentes bloqueadores neuromusculares pueden dejar síntomas residuales que persisten durante semanas o meses.
Patología y fisiopatología
Los mecanismos que contribuyen a la neuropatología en COVID-19 pueden agruparse en categorías superpuestas de infección viral directa, inflamación sistémica grave, neuroinflamación, trombosis microvascular y neurodegeneración. Si bien se han informado previamente partículas virales en el cerebro con otras infecciones por coronavirus, aún no hay evidencia convincente de que el SARS-CoV-2 infecte neuronas. Sin embargo, las series de autopsias han demostrado que el SARS-CoV-2 puede causar cambios en el parénquima cerebral y los vasos, posiblemente por efectos sobre las barreras hemato-encefálica y sangre-líquido cefalorraquídeo, que provocan inflamación en neuronas, células de apoyo y vasculatura cerebral. Además, los niveles de activación inmunitaria se correlacionan directamente con los cambios cognitivo-conductuales.
La inflamación (una inflamación cerebral crónica de bajo nivel), junto con la capacidad reducida de responder a nuevos antígenos y la acumulación de células T de memoria (características de la inmunosenescencia en el envejecimiento y la lesión tisular), pueden desempeñar un papel en los efectos persistentes del COVID-19. . Otros mecanismos propuestos incluyen el drenaje linfático disfuncional de los órganos circumventriculares, así como la invasión viral en los espacios extracelulares del epitelio olfatorio y la difusión pasiva y el transporte axonal a través del complejo olfatorio.
En pacientes con COVID-19 se han encontrado biomarcadores de lesión cerebral, como niveles elevados de neurofibrillas de cadena ligera en sangre periférica, con un aumento más sostenido de infecciones graves, lo que sugiere la posibilidad de una lesión neuronal más crónica. La niebla mental posterior a COVID en pacientes críticamente enfermos con COVID-19 puede evolucionar a partir de mecanismos como el desacondicionamiento o el PTSD. Sin embargo, los informes de confusión mental después de un COVID-19 leve sugieren que la disautonomía también puede contribuir.
Por último, el deterioro cognitivo a largo plazo está bien reconocido en el contexto de una enfermedad poscrítica, y ocurre en el 20-40% de los pacientes dados de alta de una UCI.
Consideraciones de manejo
Deben implementarse terapias estándar para complicaciones neurológicas como dolores de cabeza, con evaluación por imágenes y derivación a un especialista para la cefalea refractaria. Se debe considerar una evaluación neuropsicológica adicional en el contexto de una enfermedad posaguda en pacientes con deterioro cognitivo. Deben utilizarse herramientas de detección estándar para identificar a los pacientes con ansiedad, depresión, trastornos del sueño, trastorno de estrés postraumático, disautonomía y fatiga.
Secuelas renales
Epidemiología y manifestaciones clínicas.
La lesión renal aguda grave (IRA) que requiere terapia de reemplazo renal (TRR) ocurre en el 5% de todos los pacientes hospitalizados y en el 20-31% de los pacientes críticamente enfermos con COVID-19 agudo, particularmente entre aquellos con infecciones graves que requieren ventilación mecánica. Los primeros estudios con seguimiento a corto plazo en pacientes que requerían TRR mostraron que el 27-64% eran independientes de la diálisis a los 28 días o al alta de la UCI.
Se notificó una disminución de la tasa de filtración glomerular estimada (TFGe; definida como <90 ml min − 1 por 1,73 m2) en el 35% de los pacientes a los 6 meses en el estudio chino pos COVID-19 agudo, y el 13% desarrolló una reducción de nueva aparición de TFGe durante el COVID-19 agudo . Con datos de seguimiento adecuados a más largo plazo, aquellos pacientes que requieren TRS por IRA grave experimentan una alta mortalidad, con una probabilidad de supervivencia de 0,46 a los 60 días y tasas de recuperación renal del 84% entre los supervivientes.
Patología y fisiopatología
El SARS-CoV-2 se ha aislado del tejido renal, y la necrosis tubular aguda es el hallazgo principal observado en las biopsias renales y las autopsias en COVID-19. La nefropatía asociada a COVID-19 (COVAN) se caracteriza por la variante colapsante de glomeruloesclerosis focal y segmentaria, con involución del glomérulo además de lesión tubular aguda, y se cree que se desarrolla en respuesta a la activación de interferón y quimiocinas. La asociación con los alelos de riesgo APOL1 sugiere que el SARS-CoV-2 actúa como un segundo golpe en pacientes susceptibles, de manera similar al virus de inmunodeficiencia humana y otros virus. Los trombos en la microcirculación renal también pueden contribuir potencialmente al desarrollo de lesión renal.
Consideraciones de manejo
Si bien la carga de IRA dependiente de diálisis en el momento del alta es baja, queda por ver el grado de recuperación de la función renal. Como resultado, los sobrevivientes de COVID-19 con insuficiencia renal persistente en la fase infecciosa posaguda pueden beneficiarse de un seguimiento temprano y cercano con un nefrólogo en las clínicas de sobrevivientes de LRA, respaldado por su asociación previa con mejores resultados.
Secuelas endocrinas
Epidemiología y manifestaciones clínicas.
Se ha observado cetoacidosis diabética (CAD) en pacientes sin diabetes mellitus conocida semanas o meses después de la resolución de los síntomas de COVID-19. Aún no se sabe cuánto tiempo persiste el aumento de la gravedad de la diabetes preexistente o la predisposición a la CAD después de la infección, y esto será abordado por el registro internacional CoviDiab. De manera similar, se ha informado tiroiditis subaguda con tirotoxicosis clínica semanas después de la resolución de los síntomas respiratorios. COVID-19 también puede potenciar la autoinmunidad tiroidea latente que se manifiesta como tiroiditis de Hashimoto de nueva aparición o enfermedad de Graves.
Patología y fisiopatología
Las manifestaciones endocrinas en el contexto posagudo de COVID-19 pueden ser consecuencias de una lesión viral directa, daño inmunológico e inflamatorio, así como complicaciones iatrogénicas. La diabetes preexistente puede manifestarse por primera vez durante la fase aguda de COVID-19 y generalmente puede tratarse a largo plazo con agentes distintos de la insulina, incluso si inicialmente se asocia con CAD. No hay evidencia concreta de daño duradero a las células β pancreáticas. Aunque algunas encuestas han mostrado la expresión de la ACE2 y la serina proteasa transmembrana (TMPRSS2; la proteasa involucrada en la entrada de células del SARS-CoV-2) en las células β189, el déficit primario en la producción de insulina probablemente esté mediado por factores como la inflamación o la respuesta al estrés de la infección, junto con la resistencia periférica a la insulina. Hasta ahora, no hay evidencia de que la diabetes asociada a COVID-19 pueda revertirse después de la fase aguda, ni que sus resultados difieran en los transportadores de larga distancia de COVID-19.
COVID-19 también presenta factores de riesgo de desmineralización ósea relacionados con inflamación sistémica, inmovilización, exposición a corticosteroides, insuficiencia de vitamina D e interrupción de agentes antirresortivos o anabólicos para la osteoporosis190.
Consideraciones de manejo
Las pruebas serológicas para autoanticuerpos asociados a la diabetes tipo 1 y las mediciones repetidas del péptido C posprandial deben obtenerse en el seguimiento en pacientes con diabetes mellitus recién diagnosticada en ausencia de factores de riesgo tradicionales para la diabetes tipo 2, mientras que es razonable tratar pacientes con factores de riesgo similares a la diabetes tipo 2 propensa a la cetosis. El hipertiroidismo debido a la tiroiditis destructiva relacionada con el SARS-CoV-2 puede tratarse con corticosteroides, pero también debe descartarse la enfermedad de Graves de nueva aparición.
Secuelas gastrointestinales y hepatobiliares
No se han informado secuelas gastrointestinales y hepatobiliares significativas en los sobrevivientes de COVID-19. La diseminación fecal viral prolongada ocurre en COVID-19, con ácido ribonucleico viral detectable durante una duración media de 28 días después del inicio de los síntomas de infección por SARS-CoV-2 y persistiendo durante una media de 11 días después de muestras respiratorias negativas.
COVID-19 tiene el potencial de alterar el microbioma intestinal, incluido el enriquecimiento de organismos infecciosos oportunistas y el agotamiento de comensales beneficiosos. La capacidad de la microbiota intestinal para alterar el curso de las infecciones respiratorias (eje intestino-pulmón) ha sido reconocida previamente en la influenza y otras infecciones respiratorias. En COVID-19, Faecalibacterium prausnitzii, un anaerobio productor de butirato típicamente asociado con una buena salud, se ha correlacionado inversamente con la gravedad de la enfermedad. Actualmente, los estudios están evaluando las consecuencias a largo plazo del COVID-19 en el sistema gastrointestinal, incluido el síndrome del intestino irritable postinfeccioso y la dispepsia (NCT04691895).
Secuelas dermatológicas
Las manifestaciones dermatológicas de COVID-19 ocurrieron después (64%) o concurrentes a (15%) otros síntomas agudos de COVID-19 en un estudio internacional de 716 pacientes con COVID-19, con una latencia promedio desde el momento de síntomas respiratorios superiores a hallazgos dermatológicos de 7,9 d en adultos. Solo el 3% de los pacientes notaron una erupción cutánea a los 6 meses de seguimiento en el estudio chino post-agudo COVID-19. La queja dermatológica predominante fue la caída del cabello, que se observó en aproximadamente el 20% de los pacientes. La caída del cabello puede atribuirse posiblemente a una infección viral o una respuesta al estrés resultante. Las investigaciones en curso pueden proporcionar información sobre los posibles mecanismos inmunitarios o inflamatorios de la enfermedad.
Síndrome inflamatorio multisistémico en niños (MIS-C)
Epidemiología y manifestaciones clínicas.
MIS-C, también conocido como síndrome multisistémico inflamatorio pediátrico asociado temporalmente con el SARS-CoV-2 (PIMS-TS), se define por la presencia de los siguientes síntomas en personas <21 años (o ≤19 años según definición de Organización Mundial de la Salud): fiebre; marcadores inflamatorios elevados; disfunción multiorgánica; infección actual o reciente por SARS-CoV-2; y exclusión de otros diagnósticos plausibles. Las presentaciones clínicas de MIS-C incluyen fiebre, dolor abdominal, vómitos, diarrea, erupción cutánea, lesiones mucocutáneas, hipotensión y compromiso cardiovascular y neurológico. Se han observado características superpuestas con la enfermedad de Kawasaki, una vasculitis aguda de vasos medianos pediátrica207. Sin embargo, la comparación de cohortes de enfermedad de Kawasaki y MIS-C demuestra características epidemiológicas y clínicas distintivas. Si bien el 80% de los casos de enfermedad de Kawasaki ocurren en niños <5 años y principalmente de ascendencia asiática, los pacientes con MIS-C suelen tener >7 años, abarcan un rango de edad más amplio y son de origen africano, afrocaribeño o hispano. Se ha observado una incidencia comparable de aneurisma y dilatación de la arteria coronaria entre la MIS-C y la enfermedad de Kawasaki (20 y 25%, respectivamente). Las complicaciones neurológicas de MIS-C, como dolor de cabeza, alteración del estado mental, encefalopatía, parálisis de pares craneales, accidente cerebrovascular, convulsiones, reflejos reducidos y debilidad muscular, parecen ser más frecuentes que en la enfermedad de Kawasaki. Un metanálisis combinado de estudios MIS-C informó recuperación en el 91,1% y muerte en el 3,5% de los pacientes. Los estudios en curso están evaluando las secuelas a largo plazo en estos niños (NCT04330261).
Patología y fisiopatología
El momento de la aparición de MIS-C (que se retrasó aproximadamente 1 mes con respecto a la incidencia máxima de COVID-19 en los epicentros en la primavera de 2020) y el hallazgo de que la mayoría de los pacientes son negativos para la infección aguda pero tienen anticuerpos positivos sugieren que MIS-C puede resultar de una respuesta inmune adquirida aberrante en lugar de una infección viral aguda. Los conocimientos sobre la fisiopatología de MIS-C pueden derivarse en parte de la enfermedad de Kawasaki y el síndrome de shock tóxico, con posibles mecanismos de lesión relacionados con los complejos inmunes, la activación del complemento, la formación de autoanticuerpos a través del mimetismo del hospedador viral y la liberación masiva de citocinas relacionada con la estimulación de superantígenos de Células T
Consideraciones de manejo
Las recomendaciones actuales incluyen terapia inmunomoduladora con inmunoglobulina intravenosa, glucocorticoides adyuvantes y aspirina en dosis bajas hasta que las arterias coronarias se confirmen como normales al menos 4 semanas después del diagnóstico. Se recomienda la anticoagulación terapéutica con enoxaparina o warfarina y aspirina en dosis bajas en aquellos con una puntuación de la arteria coronaria ≥ 10, trombosis documentada o una fracción de eyección <35%. Estudios como el Estudio del mejor tratamiento disponible para afecciones inflamatorias asociadas con COVID-19 (ISRCTN69546370) están evaluando la elección óptima de agentes inmunomoduladores para el tratamiento.
Se recomienda una evaluación ecocardiográfica en serie a intervalos de 1 a 2 y 4 a 6 semanas después de la presentación. La resonancia magnética cardíaca puede estar indicada 2-6 meses después del diagnóstico en aquellos que presentan disfunción ventricular izquierda transitoria significativa (fracción de eyección <50%) en la fase aguda o disfunción persistente para evaluar fibrosis e inflamación. Se recomiendan electrocardiogramas en serie y la consideración de un monitor cardíaco ambulatorio en las visitas de seguimiento en pacientes con anomalías de la conducción en el momento del diagnóstico.
Consideraciones Especiales
Consideraciones raciales y étnicas
Se ha reconocido que el COVID-19 agudo afecta de manera desproporcionada a las comunidades de color. Un total del 51,6% de los supervivientes en el estudio posaguda de COVID-19 en EE. UU. eran negros, mientras que el grupo BAME comprendía entre el 19 y el 20,9% en los estudios del Reino Unido. Sólo un estudio del Reino Unido evaluó la asociación de raza / etnia e informó que los individuos pertenecientes al grupo BAME tenían más probabilidades de experimentar disnea que los individuos blancos (42,1 versus 25%, respectivamente) a las 4-8 semanas posteriores al alta. Las tasas de PTSD fueron similares en los participantes BAME y blancos en este estudio. Los datos emergentes también sugieren que COVAN puede ser el patrón predominante de lesión renal en personas de ascendencia africana177. También se sabe que MIS-C afecta de manera desproporcionada a niños y adolescentes de etnia africana, afrocaribeña o hispana. Se requieren estudios más amplios para determinar la asociación entre las secuelas del COVID-19 posaguda y la raza y el origen étnico.
Estas importantes diferencias observadas en los estudios preliminares pueden estar relacionadas con múltiples factores, que incluyen (pero no se limitan a) determinantes socioeconómicos y disparidades raciales / étnicas, diferencias plausibles en la expresión de factores involucrados en la patogénesis del SARS-CoV-2 y comorbilidades. Se ha informado una mayor expresión epitelial nasal de TMPRSS2 en individuos de raza negra en comparación con otras razas / etnias autonotificadas. Sin embargo, se debe tener cuidado de que los estudios en curso y futuros integren y analicen la información a lo largo de múltiples ejes (por ejemplo, los ejes clínico y socioeconómico, los déficits de recursos y los factores estresantes externos) para evitar una contextualización inexacta. El Instituto Nacional de Salud y Disparidades de Salud de las Minorías de los Institutos Nacionales de Salud ha identificado la investigación de los efectos a corto y largo plazo del COVID-19 en la salud, y cómo se pueden reducir los resultados diferenciales entre grupos raciales y étnicos, como una prioridad de investigación.
Consideraciones de nutrición y rehabilitación
El COVID-19 severo, similar a otras enfermedades críticas, causa desgaste muscular catabólico, dificultades para alimentarse y fragilidad, cada uno de los cuales se asocia con una mayor probabilidad de un mal pronóstico. Se ha observado desnutrición en el 26-45% de los pacientes con COVID-19, según la evaluación de la herramienta de detección universal de desnutrición en el estudio italiano. Se siguen perfeccionando los protocolos para proporcionar apoyo nutricional a los pacientes (muchos de los cuales padecían dificultad respiratoria, náuseas, diarrea y anorexia, con la consiguiente reducción de la ingesta de alimentos ).
Todos los estudios de seguimiento post-agudo de COVID-19 que incorporaron evaluaciones de la calidad de vida relacionada con la salud y medidas de capacidad funcional han informado universalmente déficits significativos en estos dominios, incluso a los 6 meses en el estudio chino post-agudo de COVID-19. Dada la gravedad de la respuesta inflamatoria sistémica asociada con el COVID-19 grave y la fragilidad resultante, se están evaluando programas de rehabilitación temprana en estudios clínicos en curso. Se ha validado previamente que son seguros y eficaces en pacientes críticamente enfermos con SARS y en estudios preliminares en COVID-19. Las unidades de rehabilitación modelo COVID-19, como las de Italia, ya están evaluando rutinariamente a los supervivientes agudos de COVID-19 para determinar la función de deglución, el estado nutricional y las medidas de independencia funcional.
Grupos de defensa de pacientes
Única en esta pandemia es la creación y el papel de los grupos de defensa de los pacientes para identificar los síntomas persistentes e influir en la investigación y la atención clínica. Dichos grupos incluyen:
COVID Advocacy Exchange (https://www.covidadvocacyexchange.com),
Centro Nacional de Defensores del Paciente COVID Care Resource Center (https://www.patientadvocate.org/covidcare),
grupos de Facebook de luchadores de COVID de larga distancia,
Body Politic COVID-19 Support Group
(https://www.wearebodypolitic.com/covid19),
Survivor Corps
(https://www.survivorcorps.com/)
investigación dirigida por pacientes para COVID-19
www.patientresearchcovid19.com
Las encuestas realizadas por estos grupos han ayudado a identificar síntomas persistentes como confusión mental, fatiga y dolores corporales como componentes importantes del COVID-19 posagudo. Además, han sido fundamentales para resaltar la persistencia de síntomas en pacientes con enfermedad leve a moderada que no requirieron hospitalización. El compromiso activo con estos grupos de defensa de los pacientes, muchos de los cuales se identifican como transportistas de larga duración, es crucial. La diseminación de la información de contacto y los recursos de estos grupos puede ocurrir en farmacias, consultorios médicos y en los resúmenes de alta al momento del alta hospitalaria.
Conclusiones y direcciones futuras
Las secuelas multiorgánicas de COVID-19 más allá de la fase aguda de la infección se aprecian cada vez más a medida que se acumulan los datos y la experiencia clínica en este período de tiempo. La investigación activa y futura necesaria incluye la identificación y caracterización de manifestaciones clínicas, serológicas, de imagen y epidemiológicas clave de COVID-19 en las fases aguda, subaguda y crónica de la enfermedad, lo que nos ayudará a comprender mejor la historia natural y la fisiopatología de esta nueva entidad patológica.
Los estudios clínicos activos y futuros, incluidas las cohortes prospectivas y los ensayos clínicos, junto con la revisión frecuente de la evidencia emergente por parte de grupos de trabajo y grupos de trabajo, son fundamentales para desarrollar una base de datos sólida de conocimientos e informar la práctica clínica en esta área. Actualmente, los profesionales de la salud que atienden a sobrevivientes de COVID-19 agudo tienen la función clave de reconocer, documentar cuidadosamente, investigar y controlar los síntomas nuevos o en curso, así como hacer un seguimiento de las complicaciones orgánicas específicas que se desarrollaron durante la enfermedad aguda. También es imperativo que los médicos brinden información en formatos accesibles, incluidos los estudios clínicos disponibles para la participación y recursos adicionales como la defensa del paciente y los grupos de apoyo.
Además, está claro que la atención a los pacientes con COVID-19 no concluye en el momento del alta hospitalaria, y es necesaria la cooperación interdisciplinaria para la atención integral de estos pacientes en el ámbito ambulatorio. Como tal, es crucial que los sistemas de salud y los hospitales reconozcan la necesidad de establecer clínicas dedicadas al COVID-19, donde especialistas de múltiples disciplinas puedan brindar atención integrada. Se puede considerar la priorización de la atención de seguimiento para aquellos con alto riesgo de COVID-19 posaguda, incluidos aquellos que tuvieron una enfermedad grave durante el COVID-19 agudo y / o requirieron atención en una UCI, los más susceptibles a complicaciones (por ejemplo, los ancianos, los que tienen comorbilidades multiorgánicas, los postrasplante y los que tienen antecedentes de cáncer activo) y los que tienen la mayor carga de síntomas persistentes.
Dada la escala global de esta pandemia, es evidente que las necesidades de atención médica para los pacientes con secuelas de COVID-19 continuarán aumentando en el futuro previsible. Hacer frente a este desafío requerirá aprovechar la infraestructura ambulatoria existente, el desarrollo de modelos de atención médica escalables y la integración entre disciplinas para mejorar la salud mental y física de los sobrevivientes de COVID-19 a largo plazo.
Referencia:
https://doi.org/10.1038/s41591-021-01283-z
covid 19 post agudo

Muy pocos casos de influenza en la Región Europa de la OMS registrados durante la temporada 2020/21
https://doi.org/10.2807/1560-7917.ES.2021.26.11.2100221
Cornelia Adlhoch1 , Piers Mook² , Favelle Lamb¹ , Lisa Ferland¹ , Angeliki Melidou¹ , Andrew J Amato-Gauci¹ , Richard Pebody² , the European Influenza Surveillance Network³
1. European Centre for Disease Prevention and Control (ECDC), Stockholm, Sweden
2. World Health Organization (WHO) Regional Office for Europe, Copenhagen, Denmark
3. The members of the European Influenza Surveillance Network are listed below
Correspondencia: Cornelia Adlhoch (cornelia.adlhoch@ecdc.europa.eu)
Entre las semanas 40 de 2020 y 8 de 2021, Región de Europa de la OMS experimentó un 99,8%
reducción en las detecciones positivas del virus de la influenza centinela (33 / 25.606 analizados; 0,1%) en relación con un promedio de 14.966 / 39.407 (38,0%; p <0,001) sobre el mismo período en las seis temporadas anteriores.
Las medidas de salud pública y de distanciamiento físico por la pandemia de COVID-19 pueden
haber extinguido la temporada europea 2020/21 de epidemia de influenza con solo algunas detecciones esporádicas de todos los subtipos virales. Esto posiblemente continúe durante el resto de la temporada de influenza.
Estudiamos las características de la epidemiología de la influenza en la Región Europea de la Organización Mundial de la Salud (OMS) desde la semana 40 de 2020 hasta la semana 8 de 2021, un período en el que en las temporadas habituales se esperaría la mayor actividad de la influenza (pico de epidemia estacional).
Los resultados se comparan con los de las seis temporadas anteriores
(2014 / 15-2019 / 20).
Vigilancia de la influenza en la Región de Europa de la OMS
La vigilancia de la influenza en la Región de Europa de la OMS es coordinada conjuntamente por el Centro Europeo de Prevención y Control de Enfermedades (ECDC) y la Oficina Regional para Europa de la OMS
Los países y territorios informan semanalmente al Sistema Europeo de Vigilancia (TESSy) datos sindrómicos y / o virológicos. Los datos proceden de centros de atención primaria centinela (utilizando definiciones de caso de enfermedad similar a la influenza (ETI) o infección respiratoria aguda (IRA)), centros hospitalarios designados (para hospitalización por influenza confirmada por laboratorio o casos de IRA grave ), así como en entornos no centinela, como los que se encuentran en el contexto de brotes, laboratorios de diagnóstico de atención primaria, hospitales y otras instalaciones sanitarias. Los datos virológicos notificados incluyen información sobre los tipos, subtipos y linajes de virus circulantes.
En la vigilancia centinela, el número de muestras analizadas se utiliza como denominador para calcular la positividad del virus de la influenza, que es un indicador de la actividad e intensidad de la influenza.
Los datos se publican semanalmente en la página web FluNewsEurope.
La pandemia de COVID-19 y la influenza en 2020.
A fines de 2019, surgió en China [3] el síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2), responsable de la enfermedad por coronavirus (COVID-19), desde donde se propagó aún más. Posteriormente, esto dio lugar a una pandemia declarada el 11 de marzo de 2020, que aún continúa. La implementación durante la pandemia de estrictas medidas de salud pública (por ejemplo, trabajar desde casa, cerrar escuelas, limitar las reuniones sociales, aumentar las medidas de higiene, usar máscaras, etc.) para disminuir la transmisión del SARS-CoV-2 también redujo la circulación de otros virus respiratorios. Esto se reflejó en un bajo nivel histórico de actividad de la influenza en el hemisferio sur en 2020 y en otros lugares.
Para la Región de Europa de la OMS, en el otoño de 2020, pronosticamos una actividad de influenza inusualmente tardía y de bajo nivel para el invierno de 2020/21, en función del bajo número de muestras que dieron positivo al virus de la influenza, detectadas en los meses de verano por vigilancia centinela y no centinela, a pesar de las pruebas sustanciales para el virus de la influenza durante la pandemia COVID-19.
La temporada 2020/21 en la Región de Europa de la OMS.
Describimos con más detalle el número total de casos de influenza
y número de muestras analizadas para el virus de la influenza de los sistemas de vigilancia centinela, no centinela y hospitalaria en la Región desde la semana 40 de 2020 a la semana 8 de 2021. Los resultados se comparan con los promedios, mínimos y máximos de las seis temporadas anteriores (2014 / 15-2019 / 20). Usamos una prueba t pareada con un nivel de significancia p = 0.05.
Resultados de la vigilancia centinela
Entre las semanas 40 de 2020 y 8 de 2021, 37 países y territorios de la Región de Europa de la OMS analizaron 25,606 muestras centinela, de las cuales 33 dieron positivo al virus de la influenza, con virus de tipo A y B detectados en 11 países. Entre los virus de tipo A, se detectaron 13 virus de influenza A (H1) pdm09 en comparación con seis A (H3) y uno de tipo A sin subtipificar; dos de los 13 virus de tipo B detectados se atribuyeron a un linaje, B/Victoria. Este número de muestras que dieron positivo es 99,8% menor que en cualquier período comparable anterior (primeras 22 semanas de la temporada 2014/15-2019/20) cuando un promedio de 14.966 muestras dieron positivo (rango: 12,176–18,748). El nivel de especímenes centinela analizados en 2020/21 fue similar al de temporadas anteriores entre las semanas 40 de 2020 y 2 de 2021, pero más bajo que la semana 3 de 2021. En comparación con temporadas anteriores y períodos de tiempo respectivos, el número total de especímenes centinela analizados fue menor
que el promedio de 39.407 especímenes de 2014/15 a 2019/20 (rango: 32,746–45,124; p <0.01).
Se estimó una positividad significativamente menor de 0.1% (33/25.606) en comparación con una positividad promedio del 38% (14.966/39.407) entre la semana 40 y la semana 8 (p <0.001). La positividad del 0,3% (3/1.045) observada en la semana 8 de 2021 indicó una reducción excepcional en la actividad en comparación con una positividad esperada del 48,6% (1.340 / 2.755) para la semana 8, basada en el promedio de temporadas anteriores.
Resultados de la vigilancia no centinela
Para la semana 8 de 2021, 35 países y territorios analizaron 424,541 muestras de fuentes no centinelas, de las cuales 679 dieron positivo al virus de la influenza. Las muestras positivas se notificaron en 19 países y territorios de la Región de Europa de la OMS; el Reino Unido (RU) notificó la mayoría de los casos (488; 72%). Se informó un número similar de virus de tipo A y B (343 frente a 336). Entre los virus de la influenza A, 278 no estaban subtipificados, 28 eran A (H1) pdm09 y 37 A (H3). Entre los virus B, 328 no tenían linaje determinado, seis eran B / Victoria y dos B / Yamagata.
Por lo tanto, la mayoría (89%; 606/679) de los virus se informó sin subtipo o linaje.
El número de detecciones de virus de influenza no centinela, similar a las detecciones centinela, es 99,4% menor que el promedio de 117,777 muestras que dieron positivo observadas durante períodos de tiempo comparables en temporadas anteriores (rango: 63,409-165,375; p <0,001; Figura 4A). El número de especímenes analizados de fuentes no centinela cae en el rango esperado en comparación con períodos de tiempo similares durante las últimas seis temporadas (promedio: 469,126; rango: 275,295-604,420; p = 0.15) (Figura 4B).
Gravedad / hospitalización
La circulación sustancialmente menor de lo esperado de los virus de la influenza esta temporada resultó en un pequeño número de hospitalizaciones por influenza confirmadas por laboratorio. Hasta la semana 8 de 2021, solo Ucrania notificó nueve casos de influenza hospitalizados en unidades de cuidados no intensivos (no UCI) y dos países (Ucrania e Inglaterra) informaron dos y nueve casos de influenza hospitalizados en UCI, respectivamente.
En contraste con estos nueve casos fuera de la UCI y 11 en la UCI, en temporadas anteriores hasta el mismo momento, se notificaron entre 1.991 y 13.849 casos fuera de la UCI y entre 2.844 y 7.497 casos en la UCI con influenza confirmada por laboratorio en cinco a 11 países y nueve a 16 países, respectivamente. Las cifras obtenidas hasta ahora en la temporada 2020/21 representan reducciones del 99,9% (no UCI) y del 99,8% (UCI) en el número de casos en comparación con los promedios respectivos de 6.904 (no UCI) y 4.602 (UCI) casos para la misma período en temporadas anteriores (p <0,001). De la vigilancia basada en IRAG, 13 países y territorios no pertenecientes a la UE / AEE analizaron 8.446 casos de IRAG (infección respiratoria aguda grave) por influenza y solo 15 casos (0.2%) fueron reportados positivos, 11 de Ucrania (ocho A (H1) pdm09 y tres de tipo A sin subtipo), tres de Armenia (todos A (H3N2)) y uno de Azerbaiyán (virus tipo B). Esta temporada se realizaron pruebas de influenza significativamente más con IRAG en comparación con el promedio de 7,213 (rango: 4,358–8,733; p = 0.02) durante el mismo período durante las últimas seis temporadas, cuando 2,175 (30.2%; rango: 1,098–3,212) dio positivo. A pesar del aumento de las pruebas, se observó una reducción del 99,3% en casos de influenza durante la temporada actual.
Mientras que en las muestras de atención primaria centinela y no centinela derivadas de IRAG, se detectó una mezcla de todos los subtipos y linajes (aunque con pruebas de linaje / B limitadas), en la vigilancia hospitalaria basada en laboratorio, se observó más influenza A, particularmente A (H1) pdm09, en las que no estaban en la UCI, siete de los nueve virus de tipo A se subtipificaron como A (H1) pdm09, mientras que en la UCI las 11 muestras eran virus de tipo A, uno con el subtipo A (H1) pdm09. El bajo número de detecciones en general limita la interpretación de estos hallazgos.
Discusión
Durante las epidemias estacionales anuales en años no pandémicos, la influenza causa una gran carga en la población y los sistemas de salud de la Región de Europa de la OMS. La pandemia de COVID-19 hasta 2020 y 2021 tuvo un gran impacto en la circulación de la influenza en la Región de Europa de la OMS, así como a nivel mundial. Esta temporada de influenza 2020/21 es excepcional desde la creación de la red Global Influenza Surveillance and Response System (GISRS) en 1952. A pesar de que los países analizan una gran cantidad de muestras para la influenza, muy probablemente en paralelo al SARS-CoV-2, p. Ej. Utilizando ensayos múltiples, en la Región de Europa de la OMS sólo se han informado detecciones esporádicas de virus de la influenza de todos los tipos, subtipos y linajes. El umbral epidémico del 10% de positividad no se ha alcanzado en la región, y las detecciones de influenza estacional, así como de ILI e IRA (datos no mostrados) fueron más bajas que las observadas incluso durante los meses regulares de verano. Los países han realizado grandes esfuerzos para minimizar el impacto de la pandemia de COVID-19 en curso en la vigilancia de la influenza. En el pasado, los esfuerzos de vacunación y las campañas de comunicación sobre el comportamiento individual para minimizar la influenza se han llevado a cabo con un éxito limitado en la reducción de la circulación del virus, sin embargo, no se han adoptado medidas estrictas como el cierre de escuelas, los pedidos para quedarse en casa, el uso de máscaras y la reducción general del movimiento de población a nivel mundial, regional y localmente. Debido al menor número de reproducción (R0) del virus de la influenza en comparación con el SARS-CoV-2, es probable que estas medidas expliquen el impacto mucho más fuerte en la circulación de la influenza .
La vigilancia centinela se considera el estándar de oro para monitorear la actividad de la influenza y proporcionar la más alta calidad de datos de una población de pacientes ambulatorios definida (ILI o ARI) probada en los Centros Nacionales de Influenza (NIC) que también realizan análisis detallados de caracterización del virus. En la actual temporada 2020/21, la mayoría de las muestras que dan positivo a la influenza se derivan de muestras no centinela (recolectadas de diferentes fuentes sin basarse en una definición de caso clínico específico) que probablemente se muestrean para pruebas paralelas de SARS-CoV-2. Si bien los datos de la vigilancia no centinela suelen ser de menor calidad, p. Ej. la mayoría de los virus no están subtipificados / linaje determinado, la muestra más amplia de vigilancia no centinela ha proporcionado datos útiles en la situación de una pandemia que no es causada por influenza, donde la vigilancia centinela por sí sola no puede identificar tantos casos de influenza debido a los probables cambios en la búsqueda de atención médica y el comportamiento de derivación, así como el menor número general de pruebas realizadas.
Solo cuatro virus de la influenza se han caracterizado genéticamente esta temporada y ningún virus se ha caracterizado antigénicamente, lo que proporciona información limitada para las decisiones sobre la composición de la vacuna. Debido a la circulación limitada de los virus de la influenza, los NIC se han enfrentado al desafío de recolectar muestras representativas para la detección del virus de la influenza y caracterizaciones subsiguientes del virus. Se ha alentado a los países a utilizar mejor las muestras no centinela para la determinación de subtipo / linaje y la caracterización del virus.
Conclusión
La reducción coincidente de la transmisión de la influenza debido a las medidas de contención de la pandemia de COVID-19 dentro de la Región de Europa de la OMS posiblemente continuará, con una circulación de virus de la influenza de muy bajo nivel durante el resto de la temporada 2020/21, siempre que la salud pública continúe con las medidas de higiene, contención y distanciamiento.
Referencia:
https://www.eurosurveillance.org/content/10.2807/1560-7917.ES.2021.26.11.2100221
muy pocos casos de influenza en la region europa de la oms

Vacuna COVID-19 AstraZeneca: los beneficios aún superan los riesgos a pesar del posible vínculo con coágulos sanguíneos raros con plaquetas bajas en sangre.
El comité de seguridad de la EMA, PRAC, concluyó su revisión preliminar de una señal de coágulos sanguíneos en personas vacunadas con la vacuna COVID-19 AstraZeneca en su reunión extraordinaria del 18 de marzo de 2021. El Comité confirmó que:
- los beneficios de la vacuna para combatir la amenaza aún generalizada del COVID-19 (que a su vez provoca problemas de coagulación y puede ser fatal) continúan superando el riesgo de efectos secundarios;
- la vacuna no está asociada con un aumento en el riesgo general de coágulos sanguíneos (eventos tromboembólicos) en quienes la reciben;
- no hay evidencia de un problema relacionado con lotes específicos de la vacuna o con sitios de fabricación particulares;
- sin embargo, la vacuna puede estar asociada con casos muy raros de coágulos de sangre asociados con trombocitopenia, es decir, niveles bajos de plaquetas en la sangre (elementos en la sangre que ayudan a la coagulación) con o sin sangrado, incluidos casos raros de coágulos en los vasos que drenan la sangre del cerebro (CVST).
- Estos son casos raros: alrededor de 20 millones de personas en el Reino Unido y el área Económica Europea habían recibido la vacuna hasta el 16 de marzo y la EMA había revisado solo 7 casos de coágulos de sangre en múltiples vasos sanguíneos (coagulación intravascular diseminada, DIC) y 18 casos de CVST. No se ha probado un vínculo causal con la vacuna, pero es posible y merece un análisis más detallado.
El PRAC involucró a expertos en trastornos sanguíneos en su revisión y trabajó en estrecha colaboración con otras autoridades de salud, incluida la MHRA del Reino Unido, que tiene experiencia en la administración de esta vacuna a alrededor de 11 millones de personas. En general, el número de eventos tromboembólicos notificados después de la vacunación, tanto en los estudios previos a la autorización como en los informes posteriores al lanzamiento de las campañas de vacunación (469 informes, 191 de ellos de la AEMA), fue inferior al esperado en la población general. Esto le permite al PRAC confirmar que no hay un aumento en el riesgo general de coágulos de sangre. Sin embargo, en los pacientes más jóvenes persisten algunas preocupaciones, relacionadas en particular con estos raros casos.
El PRAC involucró a expertos en trastornos sanguíneos en su revisión y trabajó en estrecha colaboración con otras autoridades de salud, incluida la MHRA del Reino Unido, que tiene experiencia en la administración de esta vacuna a alrededor de 11 millones de personas. En general, el número de eventos tromboembólicos notificados después de la vacunación, tanto en los estudios previos a la autorización como en los informes posteriores al lanzamiento de las campañas de vacunación (469 informes, 191 de ellos de la AEMA), fue inferior al esperado en la población general. Esto le permite al PRAC confirmar que no hay un aumento en el riesgo general de coágulos de sangre. Sin embargo, en los pacientes más jóvenes persisten algunas preocupaciones, relacionadas en particular con estos raros casos.
Los expertos del Comité examinaron con extremo detalle los registros de DIC y CVST notificados por los Estados miembros, 9 de los cuales resultaron en muerte. La mayoría de estos ocurrieron en personas menores de 55 años y la mayoría eran mujeres. Debido a que estos eventos son raros, y el COVID-19 en sí mismo a menudo causa trastornos de la coagulación sanguínea en los pacientes, es difícil estimar una tasa de fondo para estos eventos en personas que no han recibido la vacuna. Sin embargo, en base a las cifras anteriores a COVID, se calculó que se podría haber esperado menos de 1 caso notificado de CID para el 16 de marzo entre personas menores de 50 años dentro de los 14 días posteriores a la recepción de la vacuna, mientras que se habían notificado 5 casos. De manera similar, se podría haber esperado un promedio de 1,35 casos de CVST en este grupo de edad, mientras que para la misma fecha de corte había 12. Un desequilibrio similar no fue visible en la población de mayor edad que recibió la vacuna.
El Comité opinó que la eficacia probada de la vacuna para prevenir la hospitalización y la muerte por COVID-19 supera la probabilidad extremadamente pequeña de desarrollar DIC o CVST. Sin embargo, a la luz de sus hallazgos, los pacientes deben ser conscientes de la posibilidad remota de tales síndromes, y si se presentan síntomas que sugieran problemas de coagulación, los pacientes deben buscar atención médica inmediata e informar a los profesionales de la salud sobre su vacunación reciente. Ya se están tomando medidas para actualizar la información del producto de la vacuna para incluir más información sobre estos riesgos.
El PRAC llevará a cabo una revisión adicional de estos riesgos, incluida la observación de los riesgos con otros tipos de vacunas COVID-19 (aunque hasta ahora no se ha identificado ninguna señal de monitoreo). Continuará la vigilancia estrecha de seguridad de los informes de trastornos de la coagulación sanguínea, y se están instituyendo más estudios para proporcionar más datos de laboratorio, así como pruebas del mundo real. La EMA se comunicará más a fondo según corresponda.
Información para pacientes
- La vacuna COVID-19 AstraZeneca no está asociada con un mayor riesgo general de trastornos de la coagulación sanguínea.
- Ha habido casos muy raros de coágulos de sangre inusuales acompañados de niveles bajos de plaquetas (componentes que ayudan a la coagulación de la sangre) después de la vacunación. Casi todos los casos notificados correspondieron a mujeres menores de 55 años.
- Debido a que el COVID-19 puede ser tan grave y está tan extendido, los beneficios de la vacuna para prevenirlo superan los riesgos de los efectos secundarios.
- Sin embargo, si sufre alguno de los siguientes síntomas después de recibir la vacuna COVID-19 AstraZeneca:
- falta de aliento
- dolor en el pecho o el estómago,
- hinchazón o frialdad en un brazo o una pierna,
- dolor de cabeza intenso o que empeora o visión borrosa después de la vacunación,
- sangrado persistente,
- múltiples pequeños hematomas, manchas rojizas o violáceas, o ampollas de sangre debajo de la piel,
- Busque asistencia médica inmediata y mencione su reciente vacunación.
Información para profesionales sanitarios
Se han notificado casos de trombosis y trombocitopenia, algunos de los cuales se presentan como trombosis de la vena mesentérica o de la vena cerebral/seno venoso cerebral, en personas que habían recibido recientemente la vacuna COVID-19 AstraZeneca, que ocurren principalmente dentro de los 14 días posteriores a la vacunación. La mayoría de los informes involucraron a mujeres menores de 55 años, aunque parte de esto puede reflejar una mayor exposición de dichas personas debido a que las campañas de vacunación se dirigen a poblaciones particulares en diferentes Estados miembros.
El número de eventos notificados supera los esperados y, por lo tanto, no se puede excluir la causalidad, aunque no está confirmada. Sin embargo, dada la rareza de los eventos y la dificultad de establecer la incidencia inicial, ya que el COVID-19 en sí mismo está provocando hospitalizaciones con complicaciones tromboembólicas, la potencia de cualquier asociación es incierta.
La EMA considera que el balance beneficio-riesgo del medicamento sigue siendo positivo y no existe una asociación con los trastornos tromboembólicos en general. Sin embargo, se tomarán medidas para actualizar la ficha técnica y el prospecto con información sobre los casos de CID y CVST que se hayan producido.
Se insta a los profesionales de la salud a estar alerta ante posibles casos de tromboembolismo, DIC o CVST que ocurran en individuos vacunados.
Se debe advertir a los receptores que busquen atención médica inmediata para los síntomas de tromboembolismo y, especialmente, los signos de trombocitopenia y coágulos sanguíneos cerebrales, como moretones o sangrado fáciles, y dolor de cabeza persistente o severo, particularmente después de 3 días después de la vacunación.
Se enviará una comunicación directa al profesional sanitario (DHPC) a los profesionales sanitarios que prescriban, dispensen o administren el medicamento. El DHPC también se publicará en una página dedicada en el sitio web de la EMA.
Más sobre el medicamento
La Vacuna COVID-19 AstraZeneca es una vacuna para prevenir la enfermedad por coronavirus 2019 (COVID-19) en personas mayores de 18 años. COVID-19 es causado por el virus SARS-CoV-2. Ña Vacuna COVID-19 AstraZeneca se compone de otro virus (de la familia de los adenovirus) que ha sido modificado para contener el gen para producir una proteína a partir del SARS-CoV-2. La Vacuna COVID-19 AstraZeneca no contiene el virus en sí y no puede causar COVID-19.
Los efectos secundarios más comunes de la vacuna COVID-19 AstraZeneca suelen ser leves o /moderados y mejoran unos días después de la vacunación.
Más sobre el procedimiento
La revisión de eventos tromboembólicos con la Vacuna COVID-19 AstraZeneca se realizó en el contexto de una señal de seguridad, bajo un cronograma acelerado. Una señal de seguridad es información sobre un evento adverso nuevo o incompletamente documentado que es potencialmente causado por un medicamento como una vacuna y que justifica una mayor investigación.
La revisión fue realizada por el Comité de Evaluación de Riesgos de Farmacovigilancia (PRAC) de la EMA, el comité responsable de la evaluación de los problemas de seguridad de los medicamentos humanos. El comité de medicina humana de la EMA, CHMP, ahora evaluará rápidamente cualquier cambio necesario en la información del producto.
Actualización del 19 de marzo de 2021:
El comité de medicamentos humanos (CHMP) de la EMA evaluó los cambios propuestos por el PRAC y acordó actualizar la información del producto de la vacuna de acuerdo con las recomendaciones del PRAC. La información del producto modificada se ha publicado en el sitio web de la EMA.
Vacuna COVID19 AstraZeneca los beneficios aún superan los riesgos a pesar del posible vínculo con coágulos sanguíneos raros con plaquetas
Vacunas contra COVID-19 y embarazo: Lo que los obstetras necesitan saber
Obstet Gynecol. 2021 Mar; 137(3): 408–414.
Resumen
Las vacunas contra la enfermedad del coronavirus 2019 (COVID-19) han comenzado a distribuirse en los Estados Unidos y a ofrecerse inicialmente a grupos prioritarios, incluido el personal de atención médica y las personas que viven en centros de atención a largo plazo. Se necesita orientación sobre si las personas embarazadas deben recibir una vacuna COVID-19. Debido a que las personas embarazadas fueron excluidas de los ensayos clínicos de fase 3 iniciales de las vacunas COVID-19, se dispone de datos limitados sobre su eficacia y seguridad durante el embarazo. Una vez que se completen los estudios de toxicología reproductiva y del desarrollo, se espera que algunas empresas lleven a cabo ensayos clínicos en personas embarazadas.
Hasta entonces, las personas embarazadas y sus obstetras deberán utilizar los datos disponibles para sopesar los beneficios y riesgos de las vacunas COVID-19. Los aspectos que se deben considerar al asesorar a las embarazadas incluyen datos de estudios en animales y embarazos expuestos inadvertidamente durante los ensayos clínicos de vacunas cuando estén disponibles, riesgos potenciales para el embarazo de la reactogenicidad de la vacuna, momento de la vacunación durante el embarazo, evidencia de seguridad de otras vacunas durante el embarazo, riesgo de complicaciones por COVID -19 debido al embarazo y las condiciones subyacentes de la persona embarazada, y riesgo de exposición al coronavirus 2 (SARS-CoV-2), síndrome respiratorio agudo severo, y potencial de mitigación del riesgo.
Los Centros para el Control y la Prevención de Enfermedades, el Colegio Estadounidense de Obstetras y Ginecólogos y la Sociedad de Medicina Materno-Fetal han publicado guías que respaldan la oferta de la vacuna COVID-19 a las personas embarazadas. A medida que se disponga de información adicional de los ensayos clínicos y de los datos recopilados sobre embarazadas vacunadas, será fundamental que los obstetras se mantengan actualizados con esta información.
Menos de un año después de la identificación del síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2) que causa la enfermedad por coronavirus 2019 (COVID-19), se están comenzando a distribuir vacunas seguras y efectivas en los Estados Unidos, con la esperanza de poner fin a la pandemia de COVID-19. Aquí resumimos lo que se sabe actualmente sobre las vacunas COVID-19 y su uso durante el embarazo.
VACUNAS COVID-19 Y EL PROCESO DE APROBACIÓN DE VACUNAS EN ESTADOS UNIDOS
Seis candidatos a vacunas líderes han recibido algún tipo de apoyo del gobierno federal a través de Operation Warp Speed, la asociación entre el gobierno de EE. UU. Y la industria farmacéutica; de estos, dos son candidatos a vacuna basados en ARN mensajero (ARNm), dos se basan en vectores virales y dos son proteínas recombinantes fabricadas en un sistema de baculovirus (virus de ADN que infecta células de insectos) que se co-formulan con adyuvantes (sustancias que se agregan a las vacunas para estimular la respuesta inmune). A partir del 13 de diciembre de 2020, se han presentado solicitudes de Autorización de uso de emergencia (EUA) a la Administración de Drogas y Alimentos de los EE. UU. (FDA) para las dos vacunas candidatas basadas en ARNm; las otras vacunas aún no han completado el proceso de ensayo clínico.
La Autorización de uso de emergencia es una autoridad otorgada a la FDA para permitir el uso de productos médicos no aprobados en una emergencia de salud pública para diagnosticar, tratar o prevenir afecciones graves o potencialmente mortales cuando no existen alternativas adecuadas, aprobadas y disponibles. El proceso de EUA generalmente se considera menos riguroso que la aprobación total de la FDA a través de una Solicitud de licencia de productos biológicos, la FDA emitió una guía en octubre de 2020 que establece un estándar más alto para las vacunas COVID-19, dado que se usarían en grandes poblaciones de gente. En su orientación, la FDA recomendó que, para la emisión de una EUA, la evidencia debería ser similar a la de la aprobación total: los beneficios de la vacuna deberían superar sus riesgos según los datos de al menos una fase 3 bien diseñada. ensayo clínico (un ensayo en el que los participantes se asignan al azar para recibir un nuevo producto o un placebo) que demostró la seguridad y eficacia de la vacuna de una manera clara y convincente.
Se requieren varios niveles de revisión antes de la autorización y distribución de una vacuna contra COVID-19. El primer nivel de revisión lo realiza la Junta de Monitoreo de Seguridad y Datos del ensayo clínico, un panel de científicos independientes seleccionados para revisar la evidencia del ensayo clínico de fase 3. A continuación, los datos son revisados por científicos de carrera en la FDA, seguidos de una revisión por el Comité Asesor de Vacunas y Productos Biológicos Relacionados (VRBPAC), un comité asesor independiente de la FDA, antes de la emisión de la EUA. Después de la emisión de una EUA por parte de la FDA, el Comité Asesor sobre Prácticas de Inmunización (ACIP), un comité asesor independiente de los Centros para el Control y la Prevención de Enfermedades (CDC), revisa el EUA y proporciona recomendaciones para las poblaciones a vacunar. Debido a que se cree que la demanda de vacunas COVID-19 excede inicialmente la oferta, el ACIP publicó recomendaciones provisionales el 3 de diciembre de 2020, dando prioridad al personal de atención médica y a las personas que viven en centros de atención a largo plazo para ser los primeros en recibir vacunas contra COVID-19.
Las seis vacunas candidatas desarrolladas contra COVID-19 utilizan diferentes tecnologías. La mayoría de las vacunas aprobadas anteriormente funcionan introduciendo un antígeno en el cuerpo para producir una respuesta inmunitaria. El antígeno puede ser un agente infeccioso que ha sido inactivado o una proteína purificada del agente infeccioso. Por el contrario, las vacunas de ARNm de COVID-19 desarrolladas por Pfizer-BioNTech y Moderna funcionan al transportar la información genética necesaria para fabricar la proteína de espiga de SARS-CoV-2, la proteína que se encuentra en la superficie del virus. Una vez que la vacuna se inyecta en las células musculares, fabrican la proteína de espiga, que es reconocida por el sistema inmunológico. El ARNm nunca entra en el núcleo y, por lo tanto, no se integra en el ADN; en cuestión de horas o días, el ARNm se degrada en el citoplasma celular. Las vacunas desarrolladas por AstraZeneca – Oxford y Janssen – Johnson y Johnson utilizan un vector viral modificado para administrar la proteína de espiga de SARS-CoV-2 en las células, que luego desencadena una respuesta inmunitaria. La vacuna AstraZeneca-Oxford usa un adenovirus de chimpancé que ha sido modificado para que no pueda replicarse, mientras que la vacuna Janssen-Johnson y Johnson usa un adenovirus humano 26 que también ha sido modificado para no replicarse. El vector adenovirus 26 se usó anteriormente para hacer una vacuna exitosa contra el Ébola. Las vacunas desarrolladas por Novavax y GSK – Sanofi son vacunas de subunidades de proteínas en las que se utiliza un baculovirus para producir la proteína recombinante en células de insectos. Ambas vacunas se mezclarán con adyuvantes para estimular la respuesta inmune. El enfoque de la subunidad de proteínas se ha utilizado para fabricar otras vacunas de uso común (p. Ej., tipos de vacunas contra la influenza, la hepatitis B y el virus del papiloma humano).
VACUNAS COVID-19 Y EMBARAZO
Como ha sucedido hasta ahora con las vacunas COVID-19, tradicionalmente las personas embarazadas han sido excluidas de los ensayos clínicos de nuevos medicamentos y vacunas debido a preocupaciones sobre los efectos en el feto. Sin embargo, en los últimos años, las agencias federales han reconocido los desafíos de este enfoque. En 2013, el Instituto Nacional de Alergias y Enfermedades Infecciosas de los Institutos Nacionales de Salud estableció un panel de expertos que desarrolló pautas para el diseño de protocolos y la evaluación de la seguridad para los ensayos clínicos realizados en personas embarazadas. En 2018, la FDA publicó un borrador de guía que proporciona un marco para consideración de la inclusión de personas embarazadas en ensayos clínicos. También en 2018, el Grupo de Trabajo sobre Investigaciones Específicas para Mujeres Embarazadas y Mujeres Lactantes, un grupo federal establecido para asesorar a la Secretaría de Salud y Servicios Humanos, reconoció que, “la inclusión de mujeres embarazadas y mujeres lactantes en los ensayos clínicos es esencial, a menos que existan razones científicas convincentes para su exclusión ”.
A pesar del reconocimiento de la necesidad de incluir a las personas embarazadas en los ensayos clínicos, la velocidad con la que se desarrollaron las vacunas COVID-19 y se llevaron a cabo los ensayos impidió la inclusión de las personas embarazadas.
En una guía publicada en junio de 2020, la FDA recomendó que las compañías farmacéuticas lleven a cabo estudios de toxicología reproductiva y del desarrollo antes de inscribir a las personas embarazadas o que no eviten activamente el embarazo en sus ensayos.
Los estudios de toxicología reproductiva y del desarrollo, que generalmente utilizan animales para evaluar los efectos potenciales de un nuevo medicamento o vacuna en el espectro completo de reproducción, aún no se han completado para ninguna de las vacunas COVID-19, a excepción de la vacuna Moderna, que presentó los resultados a la FDA el 4 de diciembre de 2020; por lo tanto, las personas embarazadas aún no se han inscrito. Se espera que en un futuro próximo se envíe a la FDA un informe preliminar de los estudios de toxicología reproductiva y del desarrollo de la vacuna Pfizer-BioNTech. Según los documentos informativos del VRBPAC sobre la vacuna Moderna, 8 se realizó un estudio combinado de desarrollo, perinatal y posnatal en ratas y no mostró efectos adversos sobre la reproducción femenina, el desarrollo fetal o embrionario o el desarrollo posnatal. Se prevé que los ensayos clínicos sobre la seguridad e inmunogenicidad de la vacuna COVID-19 para embarazadas podrían comenzar en enero de 2021. Debido a que la vacuna ya ha demostrado ser eficaz en adultos y adolescentes mayores de 16 años, los ensayos pueden utilizar correlatos de inmunidad (por ejemplo, anticuerpos neutralizantes) en lugar de la adquisición de COVID-19 como resultado.
Algunas compañías que desarrollaron vacunas COVID-19 pueden planear incluir a personas embarazadas en ensayos clínicos en el futuro, pero todos los estudios actuales no solo excluyeron a las participantes embarazadas, sino que solicitaron la confirmación de un plan de anticoncepción durante semanas o meses después de la inyección. Por tanto, actualmente se dispone de muy poca información sobre la seguridad y la eficacia en el embarazo.
Al 14 de noviembre, Pfizer informó que había 23 personas embarazadas inscritas inadvertidamente en su ensayo clínico, incluidas 12 en el grupo de la vacuna; estos embarazos están en curso. Moderna informó de 13 embarazos en su ensayo clínico, incluidos seis en el grupo de la vacuna y siete en el grupo de placebo. Los embarazos expuestos a la vacuna están en curso.
El ACIP de los CDC publicó una guía provisional que recomienda que se incluya al personal de atención médica en la fase inicial para recibir la vacuna debido al alto riesgo de exposición. Dado que aproximadamente el 75% de la fuerza laboral de atención médica son mujeres, los CDC estiman que aproximadamente 300,000 miembros del personal de atención médica podrían estar embarazadas o recientemente en el posparto en el momento de la implementación de la vacuna.
La gran mayoría de las vacunas están permitidas durante el embarazo cuando se considera que el beneficio de la vacuna supera el riesgo potencial. Desafortunadamente, aparte del pequeño número de exposiciones inadvertidas durante el embarazo informadas en los ensayos clínicos recientes de la vacuna COVID-19, no hay experiencia previa con mujeres embarazadas para las vacunas de ARNm, el tipo de vacunas que primero estuvo disponible en los Estados Unidos. Sin embargo, no hay razón para esperar que las vacunas de ARNm funcionen de manera diferente en personas embarazadas que en otros adultos. Como suele ocurrir con las vacunas, los datos sobre las vacunas de ARNm de Pfizer-BioNTech muestran reactogenicidad en una proporción de pacientes, con fiebre, fatiga, dolor de cabeza, escalofríos y dolores musculares y articulares.
Se produjo fiebre (38 ° C o más) en el 3,7% de los participantes después de la dosis 1 y en el 15,8% después de la dosis 2 de las vacunas de ARNm de Pfizer-BioNTech en personas de 18 a 55 años en los ensayos clínicos. Recién nacidos de embarazadas con fiebre. en su primer trimestre de embarazo se ha demostrado que tienen un mayor riesgo de ciertos tipos de defectos congénitos, aunque el riesgo absoluto es pequeño. Los riesgos asociados con la fiebre parecen reducirse con la medicación antipirética. Se recomienda el uso juicioso de medicamentos antipiréticos después de la vacunación, dadas las posibles preocupaciones que se han planteado sobre el uso de acetaminofén durante el embarazo, así como las preocupaciones sobre si los medicamentos antipiréticos podrían disminuir la eficacia de la vacuna.
Las recomendaciones del ACIP son usar medicamentos antipiréticos para el tratamiento en lugar de para la profilaxis. Según lo que se sabe acerca de cómo las vacunas de ARNm actúan localmente (en el lugar de la inyección) y el sistema linfático las degrada y elimina rápidamente, se cree que la probabilidad de que la vacuna alcance y cruce la placenta es baja.
La reunión VRBPAC para discutir la vacuna Pfizer – BioNTech se llevó a cabo el 10 de diciembre de 2020, y la reunión para discutir la vacuna Moderna fue programada el 17 de diciembre de 2020. En la reunión del 10 de diciembre, VRBPAC votó a favor de apoyar una EUA para la Pfizer – BioNTech, y al día siguiente, la FDA anunció una EUA para esta vacuna. En una rueda de prensa celebrada el 12 de diciembre de 2020, el Dr. Peter Marks, Director del Centro de Evaluación e Investigación Biológica de la FDA, señaló que, dado que las personas embarazadas no estaban inscritas en los ensayos clínicos de vacunas, no había datos suficientes para hacer una recomendación. ; sin embargo, afirmó, «será algo que los proveedores deberán considerar de forma individual para los pacientes». 14 El 12 de diciembre de 2020, el ACIP de los CDC votó para recomendar la vacuna Pfizer-BioNTech contra COVID-19 para personas de 16 años de edad y mayores en la población de EE. UU., según la EUA de la FDA, una recomendación que fue posteriormente aceptada por el Director de los CDC.
El ACIP señaló que las personas que forman parte de un grupo recomendado para recibir la vacuna COVID-19 (por ejemplo, personal de atención médica) que están embarazadas pueden optar por vacunarse y que una conversación con su obstetra podría ayudarlas a tomar una decisión informada.
ASESORAMIENTO A LAS PERSONAS EMBARAZADAS SOBRE LAS VACUNAS COVID-19
Al sopesar los riesgos y beneficios de la vacunación COVID-19, se deben considerar varios aspectos (Cuadro 1). El obstetra debe revisar lo que se sabe de los estudios de toxicología reproductiva y del desarrollo en animales con respecto a la vacuna (cuando esté disponible) y los datos limitados sobre los resultados de las personas embarazadas expuestas inadvertidamente a la vacuna durante los ensayos clínicos. Otro tema que se discutirá son los riesgos de la enfermedad COVID-19 para una persona embarazada y el feto. Los datos actuales sugieren que las mujeres embarazadas tienen más probabilidades de ser ingresadas en una unidad de cuidados intensivos, requerir ventilación invasiva, recibir oxigenación por membrana extracorpórea y morir que las mujeres no embarazadas en edad reproductiva. Los efectos sobre el feto no se comprenden completamente. Puede ocurrir transmisión intrauterina, pero parece ser rara; sin embargo, los datos sugieren que los recién nacidos de personas con infección por SARS-CoV-2 pueden tener más probabilidades de nacer prematuramente.
El riesgo de complicaciones para la embarazada en función de factores distintos del embarazo también debe tenerse en cuenta: ¿la persona tiene una afección subyacente (por ejemplo, diabetes, obesidad o enfermedad cardíaca) que podría aumentar el riesgo de complicaciones graves por COVID-19?
Otra consideración es si el riesgo de contraer la infección puede mitigarse. Las personas embarazadas que pueden minimizar su exposición a personas con infección por SARS-CoV-2 (por ejemplo, aquellas que pueden trabajar desde casa) tienen menos riesgo. También se debe considerar si existe un riesgo de exposición para los niños que puedan contraer la infección en las escuelas u otros entornos.
El momento oportuno durante el embarazo es otra consideración. Dada la reactogenicidad de la vacuna, incluida la fiebre, la vacunación en el primer trimestre podría aumentar el riesgo de defectos del tubo neural y otros defectos congénitos. Además, es más probable que las exposiciones al comienzo del embarazo provoquen resultados adversos. Sin embargo, los riesgos de reactogenicidad de la vacuna en la persona embarazada y el feto deben sopesarse frente a los riesgos del COVID-19 en sí. Será necesaria la recopilación de datos sobre las personas que recibieron una vacuna COVID-19 durante el embarazo para proporcionar información que oriente las futuras recomendaciones de vacunas con respecto al embarazo. Pfizer Inc. se ha comprometido a realizar estudios observacionales posteriores a la autorización sobre el uso de vacunas en varias poblaciones, incluidas las personas embarazadas.
En resumen, las personas embarazadas y sus obstetras deberán utilizar los datos limitados disponibles para sopesar los beneficios y riesgos de la vacuna COVID-19 durante el embarazo, teniendo en cuenta el riesgo específico de la paciente de exposición al SARS-CoV-2. Los CDC, 15 ACOG, 17 y SMFM16 han publicado guías que respaldan la oferta de vacunas COVID-19 a las personas embarazadas. A medida que se disponga de información adicional de los ensayos clínicos y de los datos recopilados sobre personas embarazadas vacunadas fuera de los ensayos clínicos, será fundamental que los obstetras se mantengan actualizados con la información más reciente de las agencias federales (por ejemplo, CDC y FDA) y organizaciones profesionales, que se actualizarán periódicamente.
El 18 de diciembre de 2020, la FDA emitió un EUA para la vacuna Moderna COVID-19.23 El ACIP de los CDC se reunió el 19 de diciembre de 2020 y aprobó una recomendación para la vacuna Moderna COVID-19 para personas de 18 años de edad y mayor.
Consideraciones para asesorar a las personas embarazadas con respecto a la vacunación contra la enfermedad por coronavirus 2019 (COVID-19)
- Datos de estudios en animales (una vez que estén disponibles los estudios de toxicología del desarrollo y la reproducción).
- Falta de datos sobre embarazos durante los ensayos clínicos de vacunas.
- Riesgos de reactogenicidad de la vacuna, incluida fiebre; el tratamiento con medicamentos antipiréticos (p. ej., acetaminofén) podría reducir este riesgo.
- Momento de la vacunación planificada durante el embarazo.
- Amplia evidencia de la seguridad de otras vacunas durante el embarazo.
- Riesgo de complicaciones de COVID-19 debido al embarazo (mayor riesgo para la persona embarazada de enfermedad grave y muerte).
- Riesgo de complicaciones de COVID-19 debido a afecciones subyacentes (p. ej., diabetes, obesidad, enfermedad cardíaca).
- Riesgo de COVID-19 para el feto o el recién nacido (la transmisión intrauterina es rara, pero el parto prematuro parece estar aumentado)
- Riesgo de exposición al SARS-CoV-2 y potencial de mitigación con el trabajo desde casa, el uso de máscaras y el distanciamiento físico
Referencia:
Sonja A. Rasmussen, MD, MS, Colleen F. Kelley, MD, MPH, John P. Horton, MD, and Denise J. Jamieson, MD, MPH
Coronavirus Disease 2019 (COVID-19) Vaccines and Pregnancy
What Obstetricians Need to Know
Obstet Gynecol. 2021 Mar; 137(3): 408–414.
Vacunas contra COVID19 y embarazo

Eficacia de la vacuna Oxford-AstraZeneca COVID-19 en dosis única seguida de un refuerzo de 12 semanas
The Lancet, Vol 397 Marzo 6, 2021
https://www.thelancet.com/action/showPdf?pii=S0140-6736%2821%2900528-6
Las vacunas para prevenir la infección por COVID-19 son cruciales para una respuesta pandémica mundial eficaz. En The Lancet, Merryn Voysey y sus colegas informan los resultados de eficacia primaria actualizados para la vacuna Oxford-AstraZeneca ChAdOx1 nCoV-19 (AZD1222) de tres ensayos controlados aleatorios simple ciego en el Reino Unido y Brasil y un estudio doble ciego en Sudáfrica.
La Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido otorgó la autorización de uso de emergencia en adultos a la vacuna ChAdOx1 nCoV-19 en diciembre de 2020. Un informe posterior, basado en un análisis intermedio de cuatro ensayos controlados aleatorios realizados en Brasil, Sudáfrica y el Reino Unido sugirieron una eficacia general de la vacuna del 70,4% (95,8% IC 54,8-80,6), con una eficacia mayor del 90% (95% IC 67,4-97,0) en aquellos que recibieron una dosis baja (2 • 2 × 10¹⁰ partículas virales por dosis) seguida de una dosis estándar (5 × 10¹⁰ partículas virales por dosis), y una eficacia de la vacuna de 62 • 1% (95% CI 41 • 0-75 • 7) en los que recibieron dos dosis estándar (con 4 semanas de diferencia). Como resultado de estos datos provisionales, y para lograr el mayor beneficio para la salud rápidamente, el gobierno del Reino Unido decidió una política de administrar tantas primeras dosis como fuera posible y retrasar la segunda dosis de la vacuna ChAdOx1 nCoV-19 hasta 12 semanas después de la primera dosis. Aunque esta política fue criticada, los últimos resultados informados por Voysey y sus colegas proporcionan una necesaria justificación basada en la evidencia para la decisión. El estudio se basa en un análisis actualizado de 17.178 participantes (9.696 [56,4%] eran mujeres, 12.975 [75,5%] eran blancos y 14.413 [83,9%] tenían entre 18 y 55 años, 1.792 [10 • 4%] de 56 a 69 años, y 973 [5,7%] de 70 de edad o más) de los cuatro ensayos. Los resultados agrupados de estos ensayos (incluidos los participantes que recibieron dos dosis estándar y los que recibieron una dosis baja seguida de una dosis estándar) mostraron una eficacia general de la vacuna contra el COVID-19 sintomático más de 14 días después de la segunda dosis de 66 • 7% (95% CI 57 • 4–74 • 0).
La eficacia de la vacuna fue 63 • 1% (51 • 8–71 • 7) en los que recibieron dos dosis estándar y 80 • 7% (62 • 1–90 • 2) en quienes recibieron la dosis baja más la dosis estándar. En particular, en los análisis exploratorios, la eficacia de la vacuna después de una única dosis estándar fue del 76,0% (59,3–85,9) desde el día 22 hasta el día 90, y los niveles de anticuerpos se mantuvieron durante este período con una disminución mínima. Apoyando una estrategia de inmunización de intervalo más largo, la eficacia de la vacuna fue significativamente mayor al 81 • 3% (60 • 3-91 • 2) después de dos dosis estándar administradas en un intervalo de 12 semanas o más, en comparación con el 55 • 1% (33 • 0-69 • 9) cuando se administran con menos de 6 semanas de diferencia. Estos hallazgos fueron respaldados por estudios de inmunogenicidad realizados en participantes menores de 55 años, que mostraron respuestas de anticuerpos IgG de pico anti-SARS-CoV-2 más del doble en aquellos que tenían un intervalo de dosis de al menos 12 semanas que en aquellos que tuvieron un intervalo de menos de 6 semanas (razón de media geométrica 2 • 32 [95% CI 2 • 01–2 • 68]). Los análisis de modelos mostraron un aumento en la eficacia de la vacuna después de dos dosis estándar de 55 • 1% (IC del 95%: 33 • 0 a 69 • 9) con un intervalo de menos de 6 semanas a 81 • 3% (60 • 3 a 91 • 2 ) con un intervalo de al menos 12 semanas.
Una sóla dosis estándar tuvo una eficacia contra el COVID-19 sintomático en los primeros 90 días de 76 • 0% (59 • 3 a 85 • 9), pero no proporcionó protección contra la infección asintomática (eficacia de la vacuna –17 • 2% [–248 • 6 a 60 • 6]). En particular, la eficacia contra cualquier caso positivo en la prueba de amplificación de ácido nucleico, incluyendo casos sintomáticos y asintomáticos o desconocidos, fue del 63,9% (46,0 a 75,9) después de una única dosis estándar, lo que sugiere la posibilidad de reducir la transmisión viral. Las limitaciones importantes incluyen el hecho de que estos estudios no fueron diseñados prospectivamente para establecer
si la eficacia de la vacuna difiere según el intervalo de dosis; por lo tanto, estos hallazgos exploratorios post-hoc podrían estar sesgados.
Otras limitaciones son que los participantes no fueron asignados al azar al intervalo de dosificación, sólo uno de los cuatro ensayos fue doble ciego y los receptores de dosis única fueron autoseleccionados. Además, las características iniciales entre las cohortes de dosis única y de dos dosis fueron sustancialmente diferentes, con una mediana de edad más avanzada, una mayor proporción de participantes hombres y no blancos, y una proporción menor de trabajadores de la salud o de asistencia social en la cohorte de dos dosis que en la cohorte de dosis única. Además, vale la pena considerar si estos resultados se mantendrían con
circulación de variantes virales más transmisibles y letales.
En general, el valor de este estudio es proporcionar evidencia de que una dosis única de la vacuna ChAdOx1 nCoV-19 es altamente eficaz en los 90 días posteriores a la vacunación, que un intervalo de refuerzo más prolongado da como resultado una mayor eficacia de la vacuna y que la protección contra el COVID-19 sintomático se mantiene a pesar de un intervalo de dosificación más largo. Ofrece evidencia muy necesaria para la política del Reino Unido de extender el intervalo de dosificación a 12 semanas y para campañas rápidas de inmunización masiva en todo el mundo. Se necesitan más estudios para evaluar si una estrategia de intervalo más largo también ofrecería una mayor eficacia de la vacuna contra las nuevas variantes y podría ser aplicable a otros tipos de vacunas COVID-19.
IFNH es miembro del Panel Asesor sobre Vacunas COVID-19 del Gobierno de la Región Administrativa Especial de Hong Kong. GAP recibe honorarios personales de AstraZeneca por asesoramiento consultivo sobre los mensajes de la vacuna COVID-19. GAP es el presidente de un Comité de Evaluación de Seguridad para los ensayos de vacunas en investigación novedosas que no son de COVID que están llevando a cabo Merck Research Laboratories. GAP ofrece asesoramiento consultivo sobre el desarrollo de vacunas no COVID a Merck, Medicago, GlaxoSmithKline, Sanofi Pasteur, Emergent Biosolutions, Dynavax, Genentech y Genevant Sciences. GAP ha ofrecido asesoramiento consultivo sobre el diseño y la seguridad del estudio de la vacuna COVID a Eli Lilly y Company, Janssen Global Services y AstraZeneca. GAP posee patentes relacionadas con vacunas de péptidos de sarampión y vaccinia. GAP ha recibido una subvención de ICW Ventures para estudios preclínicos sobre una vacuna COVID-19 basada en péptidos.
Referencia:
Ivan F N Hung, * Gregory A Poland
Departamento de Medicina, Universidad de Hong Kong, Hospital Queen Mary, Región Administrativa Especial de Hong Kong, China (IFNH); Mayo Vaccine Research Group, Mayo Clinic, Rochester, MN 55905, EE. UU. (GAP)
poland.gregory@mayo.edu
https://www.thelancet.com/action/showPdf?pii=S0140-6736%2821%2900528-6
Eficacia de la vacuna Oxford-AstraZeneca COVID-19 en dosis única
COVID-19 y ojo: una revisión de las manifestaciones oftálmicas de COVID-19
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7942063/
La pandemia causada por el síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2) ha tenido implicaciones para la salud de una magnitud sin precedentes. La infección puede variar desde dificultad respiratoria asintomática, leve hasta potencialmente mortal. Puede afectar a casi todos los órganos del cuerpo. Los oftalmólogos de todo el mundo informan sobre diversas manifestaciones de la infección en el ojo.
La presente revisión se realizó para ayudar a los oftalmólogos a reconocer las posibles manifestaciones y el estadio de la enfermedad viral en la que aparecen comúnmente. Se realizó una búsqueda bibliográfica de las publicaciones sobre manifestaciones oftálmicas de la enfermedad por coronavirus-19 (COVID-19) entre el 1 de enero de 2020 y el 31 de enero de 2021, incluyendo 46 informes de casos, 8 series de casos, 11 estudios observacionales transversales / de cohortes, 5 estudios prospectivos intervencionistas, 3 modelos animales / estudios de autopsias y 6 revisiones / metanálisis.
La conjuntivitis es la manifestación más común y puede desarrollarse en cualquier etapa de la enfermedad. El efecto directo debido al virus, el daño tisular inmunomediado, la activación de la cascada de coagulación y el estado protrombótico inducido por la infección viral, las comorbilidades asociadas y los fármacos utilizados en el manejo son los responsables de los hallazgos en el ojo. El ácido ribonucleico viral (ARN) se ha aislado de los tejidos oculares, pero aún no se ha comprobado el papel del ojo como vía de infección. Las manifestaciones oftálmicas pueden ser la característica de presentación de la infección por COVID-19 o pueden desarrollarse varias semanas después de la recuperación. Los oftalmólogos deben estar al tanto de las posibles asociaciones de enfermedades oculares con el SARS-CoV-2 con el fin de preguntar antecedentes relevantes, buscar signos específicos, aconsejar las pruebas adecuadas y mitigar la propagación de la infección, así como diagnosticar e iniciar un tratamiento temprano de por vida y complicaciones que amenazan la visión.
La prevalencia de manifestaciones oftálmicas entre los pacientes con COVID-19 varía de 2 a 32%. La relación causal con el SARS-CoV-2 aún no se ha establecido con certeza para cualquiera de estas condiciones. Si son el resultado de una condición sistémica preexistente, si el virus, de hecho, ha agravado la condición subyacente, si el virus causa daño directo a los nervios, vasos y otras estructuras o si, en última instancia, es el propio sistema inmunológico el responsable de la patología, son algunas de las preguntas sin respuesta que requerirían estudios poblacionales más amplios con métodos estandarizados de examen, investigaciones y recopilación de datos para resolverlos. Si bien el ARN viral se ha identificado en diferentes partes del ojo, no se ha establecido su replicación e infectividad. Se está investigando activamente la transmisión del virus a través de las secreciones oculares. Existe una necesidad inminente de establecer pautas basadas en la evidencia para el uso profiláctico de antifúngicos en pacientes con alto riesgo de mucormicosis rinoorbitocerebral diagnosticados con COVID-19 que requieren corticosteroides. Las complicaciones tromboembólicas están bien establecidas.
También se requieren estudios para establecer los factores de riesgo de oclusiones vasculares oftálmicas en pacientes con COVID-19 seguidos del desarrollo de un régimen de profilaxis anticoagulante teniendo en cuenta las implicaciones oftálmicas. Al entrar en la fase de vacunación, una proporción sustancial de la población ya ha estado expuesta al virus SARS-CoV-2, ya sea en forma de enfermedad clínica manifiesta o por contacto con un paciente diagnosticado con COVID-19 con enfermedad subclínica. Varios países del mundo están experimentando un resurgimiento de casos con cepas mutadas. Definitivamente podemos esperar ver más manifestaciones de la enfermedad en el ojo e incluso grupos de casos similares. Por ahora, hemos intentado presentar una descripción general amplia de las diversas características posibles que se han publicado hasta la fecha en todo el mundo y la etapa de la enfermedad en la que se puede esperar que ayuden a los oftalmólogos a tener en cuenta la importancia de preguntar la historia específica sobre infección por COVID-19, contacto con persona infectada o síntomas relacionados. COVID-19 debe incluirse en las listas de causas de patologías oftálmicas comunes aclaradas anteriormente.
También debe sospecharse cuando hay una presentación inusual de una enfermedad en un grupo de edad o fenotipo poblacional donde no se espera como una lesión histiocítica en un individuo anciano. Saber que muchas de estas manifestaciones pueden ser la característica de presentación puede ayudar a diagnosticar la infección temprano y limitar la transmisión de la enfermedad. Pruebas como hisopado nasofaríngeo para RT-PCR, títulos de anticuerpos para infecciones previas para pacientes con molestias oftálmicas o tomografía computarizada de los senos paranasales para buscar sinusitis junto con una exploración del tórax en pacientes de alto riesgo por parte de médicos que tratan casos de COVID-19. Los casos deben ser evaluados de manera consciente y lógica. También se alienta a los oftalmólogos a informar los casos vistos en asociación con COVID-19 para agregar al conjunto de conocimientos a nivel mundial.
Referencia:
Indian J Ophthalmol. 2021 Mar; 69(3): 488–509.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7942063/
COVID-19 y ojo una revisión de las manifestaciones oftálmicas de COVID-19
Los pacientes con esquizofrenia tienen más del doble de riesgo de muerte relacionado con COVID-19.
De acuerdo con un estudio publicado en JAMA Psychiatry, las personas con esquizofrenia parecen tener más del doble de riesgo de morir por una enfermedad relacionada con COVID-19 que las personas sin esquizofrenia.
La esquizofrenia es un trastorno grave del neurodesarrollo que dura toda la vida y que afecta la forma cómo una persona piensa, siente y se comporta. Es causada por factores genéticos o ambientales y tratada con psicofármacos y psicoterapia.
En este estudio se analizaron los datos de 7,348 adultos, mayores de 18 años con diagnóstico positivo SARS-CoV-2 entre el 3 de marzo y el 31 de mayo de 2020. Los autores clasificaron a estos pacientes en tres grupos: pacientes con trastornos del espectro de la esquizofrenia (n = 75), trastornos del estado de ánimo (n = 564) y trastornos de ansiedad (n = 360).
Los pacientes de cada categoría se compararon con 6.349 pacientes que no tenían diagnósticos psiquiátricos documentados antes del 3 de marzo de 2020.
En general, 864 pacientes (11,8%) murieron o fueron dados de alta a un hospicio dentro de los 45 días posteriores al resultado positivo de la prueba.
Los investigadores encontraron que:
- después de ajustar por factores demográficos (edad, sexo y raza): los pacientes con trastornos del espectro de la esquizofrenia tenían 2,87 veces más probabilidades de morir por COVID-19 dentro de los 45 días posteriores a la prueba positiva que las personas sin enfermedad mental.
- después de ajustar los factores de riesgo médicos: los pacientes con trastornos del espectro de la esquizofrenia tenían 2,67 veces más probabilidades de morir por COVID-19 dentro de los 45 días posteriores a la prueba positiva que las personas sin enfermedad mental.
- después de ajustar por factores similares, los investigadores encontraron que los pacientes con trastornos del estado de ánimo y trastornos de ansiedad no tenían más probabilidades de morir a causa del COVID-19 en comparación con las personas sin enfermedad mental.
El hallazgo más importante de este estudio es el alto riesgo de mortalidad asociado con los diagnósticos del espectro de la esquizofrenia, ocupando el segundo lugar detrás de la edad. Los resultados de este análisis sugieren que el riesgo de enfermedad grave o mortal puede variar según el diagnóstico. En una población que puede ser más susceptible a la infección, es necesario determinar qué pacientes pueden estar en mayor riesgo de resultados adversos para orientar la toma de decisiones clínicas, incluida la necesidad de una mejor supervisión e intervenciones específicas.
Los autores del estudio expresaron que «es posible que se necesiten intervenciones específicas para los pacientes con enfermedades mentales graves para prevenir el empeoramiento de las disparidades en la salud”.
Los datos de los pacientes fueron tomados del Sistema de Salud Langone de la Universidad de Nueva York. El sistema incluye más de 260 oficinas para pacientes ambulatorios y 4 hospitales de cuidados intensivos en Manhattan, Brooklyn y Long Island, Nueva York.
Autores: Katlyn Nemani, M.D., of New York University Langone Medical Center and colleagues.
Extraído de:
Psych News Alert: Patients With Schizophrenia Have More Than Twice the Risk of Death Related to COVID-19
Esquizofrenia y COVID19

Linfadenopatía supraclavicular de inicio agudo coincidente con la vacunación de ARNm para COVID-19 puede estar relacionada con la técnica de inyección de la vacuna
https://www.eurosurveillance.org/content/10.2807/1560-7917.ES.2021.26.10.2100193
El seguimiento de las reacciones adversas después de la inmunización es fundamental, especialmente para las nuevas vacunas. Aquí se describen 20 casos de inicio agudo de una linfadenopatía supraclavicular única que se manifiesta entre 24 horas y 9 días después de la administración intramuscular ipsolateral de la vacuna para COVID-19 basada en ARNm. Los resultados indican que el aumento de tamaño de los ganglios linfáticos supraclaviculares después de la inmunización puede constituir una condición benigna y autolimitada, relacionada con un nivel superior al recomendado en el sitio de inyección.
El seguimiento de las reacciones adversas asociadas con la vacunación es uno de los factores más importantes en seguridad de las vacunas. Aunque las vacunas se encuentran entre los medicamentos más seguros actualmente en el mercado, no están completamente libre de riesgos, y pueden ocurrir eventos adversos después de la vacunación. La evaluación cuidadosa de cualquier efecto adverso posterior a la inmunización es esencial para distinguir aquellos que están causalmente relacionados con la vacunación de los que coinciden en el tiempo, con el fin de evitar desconfianza o percepciones erróneas sobre las vacunas.
Los 20 casos descritos a continuación constituyeron mujeres, con edades comprendidas entre los 25
a 60 años (mediana: 44 años). Ninguna tenía historial de reacciones adversas graves o inusuales después de la vacunación. Dos de los casos tenían antecedentes de enfermedad tiroidea, el tercer caso fue diagnosticado con tiroiditis autoinmune en el transcurso del trabajo de diagnóstico, y otros
dos casos tenían síndrome de Sjögren. En cinco pacientes se realizó una punción-aspiración con aguja fina con resultados que mostraron signos inflamatorios reactivos, con infiltrado linfocitario y
centros germinales activos.
En una paciente también se realizó una mamografía, sin hallazgo patológico. Todas las adenopatías tenían síntomas inflamatorios (dolor, hinchazón), eran redondeadas y móviles, y casi todas, menos una, apareció en las primeras 24 horas a 9 días después de la administración de la vacuna. El paciente restante detectó la adenopatía 24 días después de la vacunación, provocada por contacto con otro caso afectado, pero ella reconoció retrospectivamente síntomas locales menores en los días anteriores.
Figura 1: Linfadenopatía supraclavicular ipsilateral al brazo de vacunación (izquierdo), vacunación COVID-19, España, 2021. A. La linfadenopatía apareció 1 día después de la primera dosis de vacuna, y está en resolución, con reducción significativa de tamaño desde el inicio. B. La linfadenopatía apareció 7 días después de la segunda dosis de vacuna y está en resolución.¹
En seis casos, los síntomas ocurrieron después de la primera dosis de vacuna, mientras que los 14 restantes ocurrieron después de la segunda dosis. Todos completaron el programa de vacunación de dos dosis. Doce de las 20 pacientes informaron espontáneamente que el punto de inyección intramuscular fue inusualmente alto, y casi todos (17/20) reconocieron una percepción similar cuando se les preguntó sobre esto específicamente (ya sea en comparación con la administración de la dosis anterior o en relación con su expectativa teórica sobre la ubicación exacta del punto de
inyección).
En tres casos, las adenopatías infraclaviculares con las mismas características también estuvieron presentes. No hubo signos de inflamación excesiva en la región deltoidea. Ninguno de los casos presentó fiebre (temperatura mayor a 38 °C). La esplenomegalia también estuvo ausente. El resto de su examen físico fue anodino. Dándole seguimiento a los casos, todos ellos mejoraron clínicamente, y 15 se resolvieron completamente entre 5 y 16 días desde el inicio.
Discusión
Las adenopatías regionales pueden constituir un signo de preocupación médica. Aunque la causa más frecuente la infección, el origen neoplásico también es posible, particularmente en ciertas localizaciones como la fosa supraclavicular. Se han descrito linfadenopatías axilares luego de vacunaciones para virus vivos atenuados como Bacillus Calmette-Guérin, sarampión-paperas-rubéola o varicela. También se han descrito, de manera más excepcional, para las vacunas inactivadas.
La inflamación o dolor a la palpación axilar debido a linfadenopatía ipsolateral en el grupo de vacunación se ha informado recientemente como una reacción adversa poco común después de la administración de la vacuna Pfizer – BioNTech vacuna (afecta hasta a una de cada 100 personas) y muy común después de la vacuna Moderna (hasta uno en 10 personas). Sin embargo, la linfadenopatía supraclavicular no se había descrito previamente como relacionada con cualquiera de estas vacunas.
Un ganglio linfático agrandado en la ubicación supraclavicular es un hallazgo preocupante que puede sugerir neoplasia linfática primaria, infección en el mediastino o neoplasia maligna metastásica del abdomen, lo que provoca exploraciones complementarias. Los ganglios linfáticos supraclaviculares drenan el cuello, pero principalmente drenan estructuras en el tórax y el abdomen.
Puede desarrollarse una linfadenopatía regional en los ganglios de la linfa que drenan el sitio de vacunación. Se ha informado que este fenómeno aparece en las primeras 2 semanas después de la vacunación y está relacionado con la activación local de la respuesta inmune. Con menos frecuencia, la ubicación reportada es supraclavicular, y ha sido descrita asociada con la vacunación contra la influenza A (H1N1) o vacunas contra el virus del papiloma humano (VPH-9).
Los casos descritos aquí desarrollaron adenopatía supraclavicular ipsilateral al sitio de vacunación, sin otros signos o síntomas de interés. Aunque cuatro casos tenían condiciones preexistentes que podrían afectar en su sistema inmunológico, ninguna relación específica se ha descrito previamente entre sus enfermedades subyacentes y el evento reportado. La hipótesis de los autores es que la técnica de inmunización puede estar relacionada con la localización de la adenopatía, con el territorio supraclavicular y no axilar, siendo la zona de drenaje más frecuente en el evento en que la inyección se administra en un lugar más alto de lo recomendado. El músculo deltoides se considera el lugar de inyección óptimo para las vacunas en el brazo. Concretamente, el sitio óptimo se ubica en el medio del músculo deltoides, alrededor de dos a tres dedos por debajo del proceso del acromion. Una variedad de lesiones, como el dolor y la disfunción del hombro, también se han relacionado con la vacunación realizada en la parte alta del brazo, donde varias estructuras anatómicas existen, incluyendo la arteria circunfleja posterior humeral, la rama anterior del nervio axilar o la bursitis subacromial de hombro.
Todos los pacientes incluidos en esta serie de casos eran trabajadores de la salud y la mayoría de ellos informaron un punto de inyección inusualmente alto, sin respetar la distancia recomendada entre el acromion y la mitad del músculo deltoides. Diecinueve de 20 casos fueron vacunados en el brazo izquierdo. Esto puede estar simplemente relacionado con el hecho de que en personas diestras la vacunación se suele aplicar en el brazo opuesto, aunque cabe señalar que los ganglios linfáticos supraclaviculares izquierdos tienen sitios de drenaje más extensos y drenan regiones más distantes que los ganglios del lado derecho.
Esta serie de casos puede ser solamente anecdótica. Sin embargo, el reconocimiento de la linfadenopatía supraclavicular como una reacción inflamatoria autolimitada en el contexto de una vacunación ipsilateral del brazo, puede orientar el diagnóstico diferencial de los pacientes y evitar exámenes complementarios innecesarios (análisis de sangre, ecografía locorregional, aspiración por punción con aguja fina, etc.). Además, si esta hipótesis es cierta, la aparición de esta reacción adversa sería fácilmente prevenible con una formación adecuada de los vacunadores en la técnica de administración de las vacunas.
Teniendo en cuenta la cantidad masiva de vacunaciones que se están llevando a cabo en Europa en primavera, esta información puede ser particularmente relevante, no solo para realizar una mayor vigilancia de este evento, sino también para prevenirlo mediante una técnica de vacunación adecuada y considerar esta posibilidad en el diagnóstico diferencial de una linfadenopatía supraclavicular de inicio agudo.
Estos resultados no pueden indicar una incidencia específica, ya que los pacientes no fueron referidos sistemáticamente al centro que evaluó esta serie de casos, y procedían de tres regiones diferentes de España. La mayoría (90%) de las dosis de vacuna de ARNm distribuidas en España fueron Pfizer – BioNTech. Los autores no creen que los hallazgos tengan un impacto en el perfil de seguridad de las vacunas ARNm para COVID-19. Aunque los eventos agudos posteriores a la inmunización descritos en esta serie están relacionados con la vacunación, no se puede establecer una causa relación. Sin embargo, estos hallazgos pueden requerir más vigilancia y la consideración de los médicos al evaluar la linfadenopatía supraclavicular aguda después la vacunación contra COVID-19. Según estos resultados, esta constituye una condición benigna y autolimitada relacionada a la técnica en el lugar de la inyección.
Referencia:
1. Citation style for this article: Fernández-Prada María, Rivero-Calle Irene, Calvache-González Ana, Martinón-Torres Federico. Acute onset supraclavicular lymphadenopathy coinciding with intramuscular mRNA vaccination against COVID-19 may be related to vaccine injection technique, Spain, January and February 2021. Euro Surveill. 2021;26(10):pii=2100193.
https://doi.org/10.2807/1560-7917.ES.2021.26.10.2100193
Linfadenopatía supraclavicular vacuna ARNm
Ciclo: “Cuentos al Acostarse”
“Cuentos al Acostarse” es un ciclo que tiene como objetivo proporcionar a madres y padres herramientas prácticas que les permitan desarrollar y fortalecer el vínculo afectivo con sus hijos desde muy pequeños a través de la lectura compartida.
Contaremos con la asesoría experta de Bernardita Muñoz Chereau, Psicóloga, Escritora infantil, Doctora en Educación de la Universidad de Bristol y actual colaboradora del Instituto de Educación de la Universidad de Londres.
Cada semana (durante 16 semanas) publicaremos un cuento
https://ciruelax.com/blog-ciruelax/
* Cada cuento tiene una guía con preguntas especialmente formuladas para que los padres puedan interactuar con sus hijos durante la lectura, ilustraciones a color y sus versiones trazadas en blanco y negro que podrán descargarse para imprimir y colorear.

Recomendaciones de salud pública para personas completamente vacunadas contra CoVID-19
Actualizado el 8 de marzo de 2021
https://www.cdc.gov/coronavirus/2019-ncov/vaccines/fully-vaccinated-guidance.html
El Centro para el Control y la Prevención de Enfermedades (CDC) de Estados Unidos, ha publicado el primer conjunto de recomendaciones de salud pública para personas completamente vacunadas. Esta guía se actualizará y ampliará en función del nivel de propagación comunitaria del SARS-CoV-2, la proporción de la población que está completamente vacunada y la ciencia en rápida evolución sobre las vacunas COVID-19.
Para los propósitos de esta guía, las personas se consideran completamente vacunadas contra COVID-19 cuando han transcurrido 2 semanas o más luego de haber recibido la segunda dosis en una serie de 2 dosis (Pfizer-BioNTech o Moderna), o 2 semanas o más después de haber recibido una única dosis en vacunas de dosis única (Johnson y Johnson (J&J) / Janssen).
Las siguientes recomendaciones se aplican a entornos no sanitarios (es decir, fuera de las instituciones de servicios de salud).
Las personas completamente vacunadas pueden:
- Visitar a otras personas completamente vacunadas en interiores sin usar máscaras ni distanciamiento físico.
- Visitar a personas no vacunadas de un solo hogar que tienen un riesgo bajo de contraer la enfermedad grave COVID-19 en interiores, sin usar máscaras o distanciamiento físico
- Abstenerse de la cuarentena y las pruebas después de una exposición conocida si es asintomático
Por ahora, las personas completamente vacunadas deben continuar:
- Tomando precauciones en público, como usar una máscara bien ajustada y distanciamiento físico.
- Usando máscaras, practicando el distanciamiento físico y cumpliendo con otras medidas de prevención cuando visitan a personas no vacunadas que tienen un mayor riesgo de contraer la enfermedad grave de COVID-19 o que tienen un miembro del hogar no vacunado con mayor riesgo de contraer un COVID-19 grave (que requiera hospitalización)
- Usando máscaras, manteniendo la distancia física y practicando otras medidas de prevención cuando visitan a personas no vacunadas de varios hogares
- Evitando las reuniones en persona de tamaño mediano y grande
- Haciéndose la prueba de detección de SARS-CoV-2 si experimenta síntomas de COVID-19
- Siguiendo las guías emitidas por empleadores individuales
- Siguiendo los requisitos y recomendaciones de viaje del CDC y del Departamento de Salud
Visión general
Las vacunas actualmente autorizadas en los Estados Unidos son altamente efectivas para proteger a las personas vacunadas contra el COVID-19 sintomático y grave. Además, un creciente volumen de evidencia sugiere que las personas completamente vacunadas tienen menos probabilidades de tener una infección asintomática y potencialmente menos probabilidades de transmitir el SARS-CoV-2 a otras personas. Aún se está investigando cuánto tiempo dura la protección de la vacuna y cuánto protegen las vacunas contra las variantes emergentes del SARS-CoV-2. Hasta que se disponga de un mayor conocimiento y aumente la cobertura de vacunación, algunas medidas de prevención seguirán siendo necesarias para todas las personas, independientemente del estado de vacunación.
Sin embargo, los beneficios de reducir el aislamiento social y relajar algunas medidas (como los requisitos de cuarentena) pueden superar el riesgo residual de que las personas completamente vacunadas se enfermen con COVID-19 o transmitan el SARS-CoV-2 a otras personas. Además, tomar medidas para relajar ciertas medidas para las personas vacunadas puede ayudar a mejorar la aceptación y el cumplimiento con la vacuna COVID-19. Por lo tanto, hay varias actividades que las personas completamente vacunadas pueden reanudar ahora, con bajo riesgo propio y siendo conscientes del riesgo potencial de transmitir el virus a otras personas.
En los espacios públicos, las personas completamente vacunadas deben seguir las instrucciones para protegerse a sí mismas y a los demás, incluido el uso de una máscara bien ajustada, distanciamiento físico (al menos 2 metros), evitar multitudes, evitar espacios mal ventilados, cubrirse al toser y estornudar, lavarse las manos a menudo, y seguir todas las orientaciones escolares o laborales aplicables. Las personas completamente vacunadas, igualmente deben estar atentas a los síntomas de COVID-19, especialmente después de una exposición a alguien con COVID-19 sospechado o confirmado. Si se desarrollan síntomas, todas las personas, independientemente del estado de vacunación, deben aislarse y ser evaluadas clínicamente para detectar COVID-19, incluida la prueba del SARS-CoV-2, si está indicada.
Recomendaciones para visitar con otras personas en entornos residenciales
Las visitas o pequeñas reuniones probablemente representan un riesgo mínimo para las personas completamente vacunadas. Las reuniones medianas o grandes y las que incluyen a personas no vacunadas provenientes de varios hogares, aumentan el riesgo de transmisión del SARS-CoV-2. Aunque el riesgo de enfermedad puede ser mínimo para la persona completamente vacunada, se debe tener en cuenta el riesgo potencial de transmitir el virus a otras personas en caso de que se infecte, especialmente si visita a personas no vacunadas con mayor riesgo de contraer COVID-19 grave, o que en sus hogares convive con personas no vacunadas con mayor riesgo de enfermedad grave.
Las personas completamente vacunadas no deben visitar ni asistir a una reunión si han dado positivo a COVID-19 en los 10 días anteriores o si están experimentando síntomas de COVID-19, independientemente del estado de vacunación de las otras personas en la reunión.
Visitas entre personas totalmente vacunadas
Es probable que las visitas en interiores entre personas completamente vacunadas que no usan máscaras o que no están físicamente alejadas entre sí son de bajo riesgo. Por ejemplo, si está completamente vacunado, es probable que tenga un riesgo bajo de contagiarse si invita amigos completamente vacunados a cenar dentro de su residencia privada.
Visitas entre personas totalmente vacunadas y personas no vacunadas
Las visitas en interiores entre personas completamente vacunadas y personas no vacunadas que no usan máscaras o que no están físicamente alejadas entre sí son probablemente de bajo riesgo para las personas vacunadas.
Por lo tanto, el nivel de precauciones que se tomen deberá determinarse según las características de las personas no vacunadas, que permanecen desprotegidas frente al COVID-19.
Personas vacunadas que visitan a personas no vacunadas de un solo hogar que no tiene personas en riesgo de COVID-19 grave
Si la persona no vacunada pertenece a un solo hogar que no tiene personas en riesgo de COVID-19 severo, pueden visitar a personas completamente vacunadas en un ambiente cerrado, sin que nadie use máscaras, con un bajo riesgo de transmisión del SARS-CoV-2.
Por ejemplo, los abuelos completamente vacunados pueden visitar el interior de la casa de su hijo sano no vacunado y sus nietos sanos sin usar máscaras o distanciamiento físico, siempre que ninguno de los miembros de la familia no vacunados corra el riesgo de contraer COVID-19 grave.
Personas vacunadas que visitan a personas no vacunadas de un solo hogar que tiene personas en riesgo de COVID-19 grave
Si alguna de las personas no vacunadas o los miembros de su hogar tienen un mayor riesgo de COVID-19 grave, todos los asistentes deben tomar precauciones, incluido el uso de una máscara bien ajustada, mantenerse al menos a 6 pies (2 metros) de distancia de los demás y visitar en espacios abiertos, exteriores o ventilados.
Por ejemplo, si una persona completamente vacunada visita a un amigo no vacunado que tiene setenta años y, por lo tanto, está en riesgo de padecer COVID grave, la visita debe realizarse al aire libre, con máscaras bien ajustadas y manteniendo la distancia física (al menos 2 metros).
Personas vacunadas que visitan a personas no vacunadas de varios hogares al mismo tiempo
Si las personas no vacunadas provienen de varios hogares, existe un mayor riesgo de transmisión del SARS-CoV-2 entre ellas. Por lo tanto, todas las personas involucradas deben tomar precauciones, incluido el uso de una máscara bien ajustada, mantenerse al menos a 2 metros de distancia de los demás y reunirse al aire libre o en un espacio bien ventilado.
Continuando con el ejemplo anterior, si los abuelos completamente vacunados están visitando a su hija no vacunada y sus nietos y los vecinos no vacunados de la hija también asisten a la reunión, la visita debe realizarse al aire libre, con máscaras bien ajustadas y manteniendo la distancia física (al menos 2 metros). Esto se debe al riesgo que representan el uno para el otro los dos hogares no vacunados.
Reuniones medianas o grandes
Todas las personas, independientemente del estado de vacunación, deben adherirse a la guía actual para evitar reuniones en persona de tamaño mediano o grande y seguir todas las guías locales aplicables que restrinjan el tamaño de las reuniones. Si deciden participar, las personas completamente vacunadas deben seguir cumpliendo con las medidas de prevención que reducen la propagación, incluido el uso de una máscara bien ajustada, mantener la distancia física de los demás y lavarse las manos con frecuencia.
Otras actividades personales o sociales fuera del hogar.
El riesgo de infección por SARS-CoV-2 durante actividades sociales públicas, como cenar en el interior de un restaurante o ir al gimnasio, es menor para las personas completamente vacunadas. Sin embargo, aún se deben tomar precauciones ya que el riesgo de transmisión en estos entornos es mayor y probablemente aumenta con la cantidad de personas no vacunadas presentes. Por lo tanto, las personas completamente vacunadas que participan en actividades sociales en entornos públicos deben seguir todas las pautas establecidas para estos entornos, incluido el uso de una máscara bien ajustada, mantener la distancia física (al menos 6 pies/2 metros), evitar multitudes, evitar espacios mal ventilados, cubrirse la tos y estornudo y se lava las manos con frecuencia.
Viajar
En este momento, el CDC no ha actualizado las recomendaciones y requisitos de viaje.
Recomendaciones para aislamiento, cuarentena y pruebas
Las siguientes recomendaciones se aplican a entornos no sanitarios.
Personas completamente vacunadas con síntomas de COVID-19
Aunque el riesgo de que las personas completamente vacunadas se infecten con COVID-19 es bajo, cualquier persona completamente vacunada que experimente síntomas consistentes con COVID-19 debe aislarse de los demás, someterse a una evaluación clínica de COVID-19 y una prueba de SARS-CoV 2 si está indicada. La persona sintomática completamente vacunada debe informar a su proveedor de atención médica sobre su estado de vacunación en el momento de la presentación al servicio de salud.
Personas completamente vacunadas sin síntomas similares al COVID después de una exposición
Las personas completamente vacunadas sin síntomas similares al COVID no necesitan ponerse en cuarentena o someterse a pruebas después de una exposición a alguien con COVID-19 sospechado o confirmado, ya que su riesgo de infección es bajo.
Las personas completamente vacunadas que no se ponen en cuarentena deben seguir controlando los síntomas de COVID-19 durante 14 días después de una exposición. Si experimentan síntomas, deben aislarse de los demás, ser evaluados clínicamente para detectar COVID-19, incluida la prueba del SARS-CoV-2, e informar a su proveedor de atención médica sobre su estado de vacunación en el momento de la presentación al servicio de salud.
Residentes completamente vacunados de entornos congregados no sanitarios
Los residentes completamente vacunados de entornos congregados que no son de atención médica (por ejemplo, centros correccionales y de detención, hogares grupales) deben continuar en cuarentena durante 14 días y someterse a la prueba del SARS-CoV-2 después de una exposición a alguien con COVID-19 sospechado o confirmado. Esto se debe a que los entornos residenciales colectivos pueden enfrentar una alta rotación de residentes, un mayor riesgo de transmisión y desafíos para mantener la distancia física recomendada.
Empleados completamente vacunados de entornos congregados no relacionados con la atención médica y otros lugares de trabajo de alta densidad
Los empleados completamente vacunados en entornos que no son de atención médica y otros lugares de trabajo de alta densidad (por ejemplo, plantas de procesamiento y fabricación de carne y aves de corral) sin síntomas similares a COVID, no necesitan ponerse en cuarentena después de una exposición; sin embargo, se recomienda realizar pruebas después de una exposición y mediante programas de detección de rutina en el lugar de trabajo.
Referencia:
Centers for Disease Control and Prevention (CDC). National Center for Immunization and Respiratory Diseases (NCIRD), Division of Viral Diseases. Interim Public Health Recommendations for Fully Vaccinated People. Updated Mar. 8, 2021. Disponible en:
https://www.cdc.gov/coronavirus/2019-ncov/vaccines/fully-vaccinated-guidance.html
Recomendaciones CDC Vacunados